
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf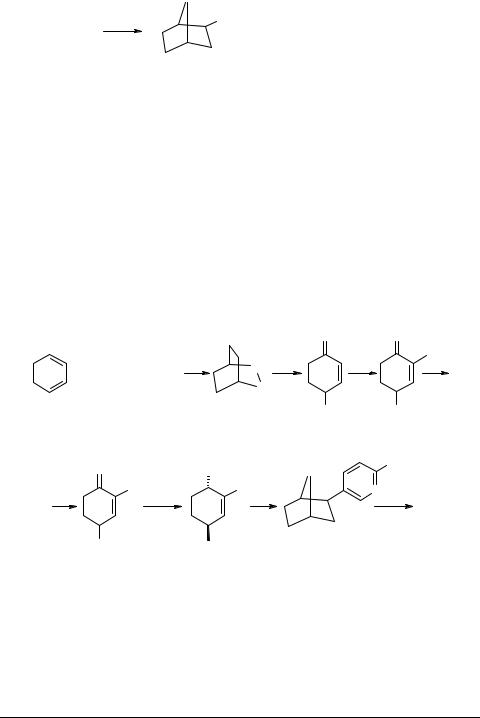
+
NH2
OSO−3
 24
24
а - несколько стадий; b - NaN3, ДМФА; с - 5% НCl;
d - SOCl2, Et3N, CH2Cl2, 0°C; e - NaIO4, RuCl3, CCl4, MeCN, H2O, 20°C; f - H2, Pd/C, ТГФ−H2О
Для построения циклогексановых предшественников ЭБ часто используют предварительную "сборку" элементов циклогексана и пиридина, после чего следует введение функциональных групп и проведение других ключевых реакций.
Например, методом гетеродиенового синтеза из 1,3-циклогексадиена удается получить аддукт 48, дальнейшие превращения которого в ключевой синтон 49 идут с выходами не менее 88% [49]. Далее следует кросс-сочетание с оловоорганическим пиридиновым реагентом, катализируемое фосфиновым комплексом палладия, приводящее к синтону 50. Слабым местом схемы является безусловно, низкая стереоселективность гидрирования, благодаря чему целевой продукт 51 составляет только одну треть от суммы стереоизомеров.
Схема 23
|
|
|
|
|
O |
O |
+ |
|
a |
O b |
c |
I |
|
|
|
|||||
t-BuO2CNHOH |
|
NBoc |
|
|
||
|
|
|
|
|
|
|
|
|
|
48 |
|
NHBoc |
NHBoc |
|
|
|
|
|
49 |
|
|
O |
|
OMs |
|
H |
X |
|
|
|
N |
|||
d |
Py |
e, f, g |
Py |
h |
|
N |
|
|
|
7 |
|||
|
|
|
|
|
|
|
|
NHBoc |
|
NHBoc |
|
|
|
|
50 |
|
|
|
51 |
|
a - Bu4NIO4, CH2Cl2, MeOH, 25°C; b - Mo(CO)6, MeCN, H2O, затем MnO2; c - I2, Py; d - Cl
 SnBu3 , Pd[(o-Tol)3P]2Cl2, ZnBr2, ДМФА;
SnBu3 , Pd[(o-Tol)3P]2Cl2, ZnBr2, ДМФА;
e - NaBH4, CeCl3.H2O, MeOH, −70°C; f - 6N HCl, 20°C; g - MsCl, Et3N; h - CF3CO2H, затем NaOH, затем CHCl3, 55°C
Избранные методы синтеза и модификации гетероциклов, том 1 |
431 |
Схема 26
Py |
Cu(CN)Li2 |
O |
O |
NOH |
|
|
|
|
c, d |
||
|
S |
+ |
a |
b |
|
|
Py |
Py |
|
||
|
|
|
|
||
|
|
|
OTMS |
OTMS |
OH |
|
57 |
|
|
56 |
|
NHTs |
NTs |
H |
N |
||
e |
Py f |
Py |
|
|
7 |
Py |
|
|
OH |
Py = 6-метокси-3-пиридил |
|
a - Et2O, −35°C → 20°C; b - NH2OH.HCl, NaOAc;
c - Ni/Al, NaOH, EtOH; d - TsCl, NaHCO3; e - DED, PPh3, ТГФ; f - Na/Hg, Na2HPO4, Et2O, HCl
Уже упоминавшаяся хинная кислота, превращенная ранее известным образом в кетон 58, послужила хиральным предшественником в синтезе (–)-ЭБ [53]. Пиридилирование кетона 58 сделано известными методами (схема 23, 24), далее последовало восстановление пиридилкетона 59 с получением защищенного диола 60. Тонким моментом является прямое введение азидогруппы, приводящее к азидомезилату 61, от которого путь к (–)-ЭБ понятен.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 27 |
|
|
|
O |
O |
OH |
||||||||||
Хинная |
|
|
|
a Py |
|
b Py |
|
с |
|||||||
кислота |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
OTBDMS |
OTBDMS |
||||||||||||
|
|
||||||||||||||
|
|
|
|||||||||||||
|
|
|
58 |
|
|
|
|
59 |
|
|
|
|
|
|
|
|
|
|
OMs |
OMs |
|
|
|
||||||||
|
Py |
|
|
|
d |
Py |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
OTBDMS |
|
|
|
|
||||||||
|
|
|
N3 |
|
|
|
|||||||||
|
|
|
60 |
|
|
|
|
61 |
|
|
|
|
|
|
|
Py = 6-хлор-3-пиридил |
|
|
|
|
|
|
|
|
|||||||
a - несколько стадий; b - K-селектрид, затем NaBH4, затем t-BuMe2SiCl; |
|||||||||||||||
с - MsCl, Et3N, DMAP; d - HN3, PPh3, EtO2CN=NCO2Et, ТГФ |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Избранные методы синтеза и модификации гетероциклов, том 1 |
433 |
||||||||||||||
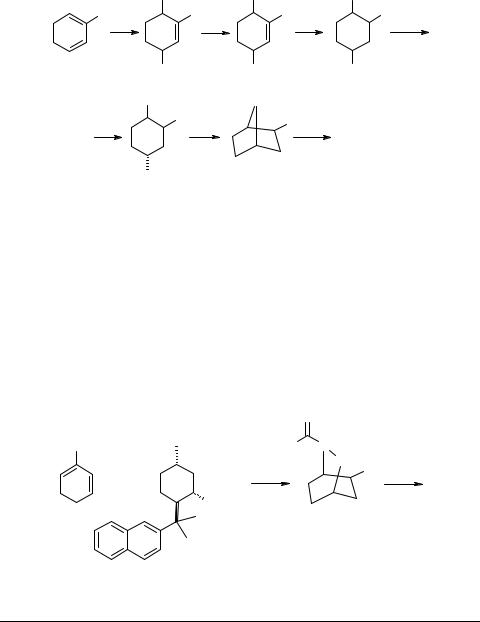
NBoc |
|
NHBoc |
|
NH2 |
|
|
O |
Py d |
Py |
e |
Py |
f |
(−)−7 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
OH |
|
Br |
|
|
а - (COCl)2, ДМСО, Et3N, CH2Cl2, −78°C; b - LiNH2.BH3, ТГФ; с - (Вoc)2O, Na2CO3; d - Mo(CO)6, MeCN, H2O, 100°C; e - PPh3, CBr4, затем CF3CO2H, CH2Cl2;
f - известные стадии
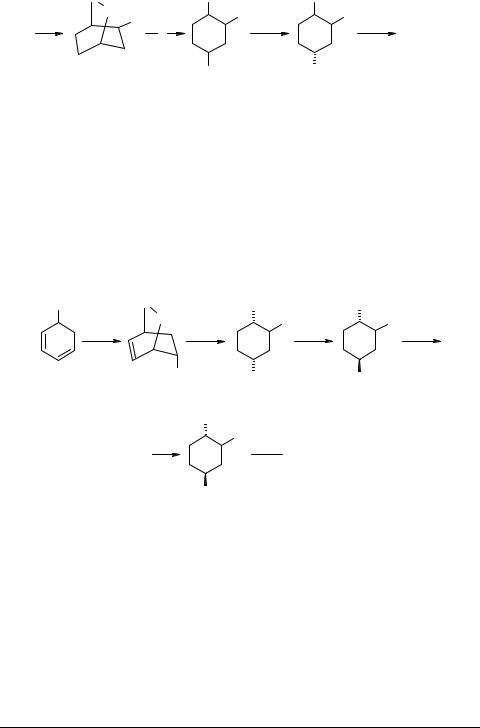
Фотоокисление 5-пиридил-1,3-циклогексадиена, сенсибилизированное порфирином с образованием эндоперекиси 64, можно рассматривать как схему, заслуживающую внимание [58].
Схема 30
Py |
O |
OMs |
OMs |
|
O |
Py d |
Py d, b |
a |
b, c |
||
|
64 Py |
OMs |
N3 |
OMs
Py e
 7
7
NH2
Py = 6-хлор-3-пиридил
а - О2, 5,10,15,20-тетрафенил-21Н,23Н-порфин, CCl4, Hg-лампа, 20°C; b - H2, Rh/Al2O3, MeOH; с - MsCl, Et3N, диоксан, 0°C;
d - NaN3, ДМФА; e - CHCl3, 55°C
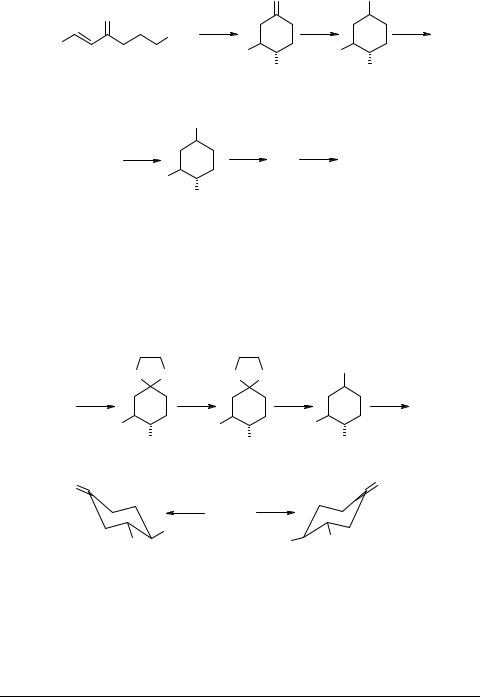
Четыре работы посвящены использованию в качестве ключевого синтона 3-пиридил-4-нитроциклогексанона 65, получаемого независимыми способами.
Согласно [59, 60], нитрокетон 65 следует получать из алифатического предшественника 66. Интересен факт получения оптических антиподов нитрокетонов путем кристаллизации с оптически активными 1-фенилэтиламинами. Без сомнения, эта находка открывает путь к синтезу обоих стереоизомерных ЭБ.
Избранные методы синтеза и модификации гетероциклов, том 1 |
435 |
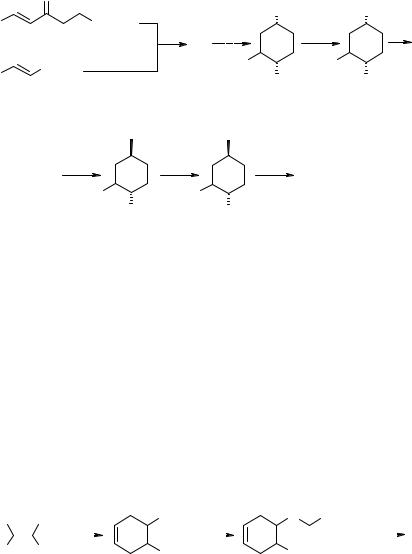
Циклизация алифатического сульфона 68 также приводит к нитрокетону 65, восстановлением которого L-селектридом с последующим мезилированием получают нитромезилат 69 с удовлетворительным выходом. Дальнейшая последовательность ясна из схемы 33 [61].
Схема 33
|
O |
|
|
OMs |
OMs |
|
|
SO2Tol a |
|
|
|||
Py |
|
|
c |
|
d |
|
|
68 |
|
65 |
|
||
|
|
|
|
|
|
|
|
b |
|
|
Py |
|
Py |
Py |
NO2 |
|
|
|
||
70 |
|
|
NO2 |
|
OH |
|
|
|
|
|
|||
|
|
|
|
69 |
|
|
|
N3 |
|
|
NH2 |
|
|
|
e |
f |
|
g |
7 |
|
|
|
|
|
|
|
|
|
Py |
|
Py |
|
|
|
|
OMs |
|
|
OMs |
|
|
Py = 6-хлор-3-пиридил
а - MeNO2, KF; b - CH2=C(OSiMe3)-CH=CH2; с - L-селектрид, затем MsCl, разделение; d - O3, затем NaBH4, MeOH; e - NaN3, затем MsCl; f - SnCl2.2H2O; g - CHCl3, 55°C
Две схемы предусматривают получение ЭБ диеновым синтезом из 6-хлор- 3-пиридил-нитроэтилена 70 [62, 63]. Последовательность превращений аналогична приведенной на схеме 33. Финальным синтоном является аминомезилат 71. Примечательной особенностью работы [63] является использование реагентов, закрепленных на полимерных носителях.
В целом, диеновый синтез лежит в основе наибольшего числа схем. Так, в первом синтезе ЭБ [14] начальной стадией является циклоприсоединение цис-6- хлор-3-пиридилакрилата к 1,3-бутадиену. Важной деталью является разделение рацемата соединения 72 на колонке с хиральной фазой. В результате был получен
(–)-ЭБ {[α]D23 –5.0°}.
|
|
|
|
|
|
|
|
|
|
|
|
|
Cхема 34 |
|
H |
|
|
|
H |
|
CO2Me |
|
H |
O(CH2)2TMS |
|||||
|
|
|
a |
b |
N |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Py |
|
|
|
CO2Me |
Py |
|
Py O |
|
|
|
||||
|
|
|
|
|
|
|
|
|
71 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Избранные методы синтеза и модификации гетероциклов, том 1 |
437 |
|||||||||||||
OMs |
|
NBz |
|
|
c |
Py |
7 |
|
|
CO2Me |
|
Py |
|
|
|
|
|
|
|
BzHN CO Me |
|
|
|
77 |
2 |
78 |
|
|
|
||
а - толуол, 110°C, затем HCl, затем DBU, МеОН; b - 3 стадии; с - t-BuOK, THF, −78°C
Элегантныйсинтез, завершившийсяполучением(–)-ЭБ{[α]D25 –6.7° (CH2Cl2)}, выполнен с применением катализированной Me2AlCl энантиоселективной реакции Дильса–Альдера. Диастереоселективность циклоприсоединения акрилата 79 к гетеродиену 80, приводящая к аддукту 81, превышает 95% [66]. В этой схеме ряд тонкостей заслуживают внимания. К их числу относятся: синтез нитрила 82 и деградация CN-группы с образованием N-Boc-аминокетона 83.
|
|
|
|
|
|
|
|
|
Схема 37 |
|
Bn |
Py |
|
OTES |
|
|
O |
|
|
|
|
|
|
NH Py |
|
||||
|
|
|
|
|
|
|
|||
|
N |
+ |
|
N |
a |
|
b |
||
O |
|
|
|
|
|
O |
|
||
O |
|
|
OTES |
|
|
|
|||
|
|
|
|
|
|
||||
|
O |
|
|
|
|
|
Bn |
N |
O |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
79 |
|
|
80 |
|
|
81 |
O |
|
|
|
|
|
|
|
|
|||
O |
|
|
|
BocO |
|
|
|
OMe O |
|
|
NH |
|
|
|
N |
|
|
||
|
Py |
c |
|
Py |
d |
O |
e |
||
|
|
|
|
|
|
||||
|
|
O |
|
|
|
|
O |
Py |
|
|
|
OMe |
|
|
|
OMe |
|
CN |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
82 |
|
|
O |
|
|
O |
|
|
O |
|
Br |
|
|
f |
|
|
g |
|
|
h |
|
Py |
|
Py |
|
|
Py |
|
|
Py |
|
|
CN |
|
O NH2 |
|
|
NHBoc |
|
NHBoc |
|
|
|
|
|
|
83 |
|
|
||
|
|
|
|
|
|
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
439 |
||||||||

