Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
O |
N |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
||
|
N |
|
|
|
|
|
R |
|
|
|
|
N |
|
O |
|
N |
|
||
H H |
O |
|
R1 |
O |
H O |
||||
|
|
||||||||
H |
N |
|
|
|
N |
|
N |
|
|
|
|
|
|
|
O |
|
|||
O |
|
|
|
|
O |
|
|
||
|
|
|
|
|
|
N |
|
||
|
|
|
|
|
N |
|
|
||
|
N |
|
|
|
|
O Ar |
H |
O |
|
|
|
|
Ar |
|
R |
||||
|
|
O |
|
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
176 |
|
|
|
177 |
|
|
178 |
6. Деструкция барбитуровых кислот и синтез азагетероциклов, не содержащих пиримидинового ядра
Известны примеры реакций, в ходе которых цикл барбитуровой кислоты разрушается и при этом образуются другие азагетероциклические системы. Наиболее очевидным синтетическим приемом такого типа является введение в молекулу барбитуровой кислоты нового гетероциклического фрагмента, после чего 2,4,6- триоксопиримидиновый цикл может быть разрушен щелочным гидролизом. Так, при синтезе 4-н-пентилпиридина 181 на первой стадии проводили присоединение 5-бутилбарбитуровой кислоты 179 к пиридону-4, получая 5-бутил-5(4-пиридил)- барбитуровую кислоту 180, которую далее гидролизовали до целевого продукта 181 [129]. Аналогично, алкилированием 5-пропилбарбитуровой кислоты α-бром- пиридином получали производное 182, гидролиз которого приводил к соответствующему 2-пиридилпроизводному малоновой кислоты 183 [130].
|
|
|
O |
|
N |
|
|
|
O |
|
N |
O |
|
|
|
|
|
|
|
|
KOH |
|
|
HN |
|
H HN |
|
|
|
||
O |
N |
O |
O |
N |
O |
N |
|
|
H |
|
|
H |
|
|
|
|
179 |
|
|
180 |
|
181 |
|
|
|
O |
N |
|
HO |
O |
|
|
HN |
|
NaOH |
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
O |
N |
O |
|
N |
OH |
|
|
|
H |
|
|
O |
|
|
|
|
182 |
|
|
183 |
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
341 |
||||||
Описаны также примеры фотохимической изомеризации 5,5-диалкилбарбиту- ровых кислот 192, в которых, наряду с ациклическими соединениями образуются алкилпроизводные гидантоина 193 [135, 136]. В аналогичные превращения вступают также 5-метилбарбитуровая кислота [137] и аллоксангидрат [138].
|
|
O |
|
|
R |
|
|
|
|
R1 |
|
O |
N |
O |
|
|
HN |
R2 hν |
|
||||
|
|
|
|||||
|
O |
N O |
|
R2 |
N |
|
|
|
|
R1 |
H |
|
|
||
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
192 |
|
|
193 |
|
|
|
O |
CO2H |
|
R |
CO2H |
||
|
R |
R |
|
OH |
|
|
|
HN |
H |
|
|
|
|
||
|
NH |
|
N |
NH |
|||
|
|
HN |
|
|
|||
O |
N O |
N |
+ |
O |
|
N |
O |
|
NH2 |
H |
|
H |
|||
|
|
|
|
|
|
|
|
|
194 |
|
|
|
|
195 |
|
Перегруппировка 1-аминобарбитуровых кислот 194 в кислой среде приводит к образованию 2-(5-оксо-4,5-дигидро-1Н-1,2,4-триазол-3-ил)-карбоновых кислот
195 [139].
При взаимодействии аллоксана 15 с о-фенилендиаминами возможно раскрытие пиримидинового цикла и образование бензпиразиновых производных 196 [140, 141]. Аналогичное превращение соединения 197 (где Rib – остаток рибозы) в щелочной среде в производное 198 описано в работе [142].
|
O |
H2N |
R |
O |
O |
|
|
|
|
|
|
||||
|
|
O H2N |
|
|
N |
|
|
HN |
|
H2N |
|
N |
R |
||
|
|
|
|
||||
|
|
|
|
|
H |
|
|
O |
N |
O |
|
|
HO |
N |
|
|
H |
|
|
|
|
|
|
|
13 |
|
|
|
|
196 |
|
|
O |
NHRib |
|
|
|
Rib |
|
HN |
|
N |
Na2CO3 |
|
|
N O |
|
|
|
|
|
|
|
|
|
O |
N |
O |
|
|
|
N |
OH |
|
|
|
|
||||
|
H |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
197 |
|
|
|
198 |
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
343 |
||||||

20.Millefiori S., Millefiori A., J. Heterocycl. Chem. 1989 26 639.
21.Jovanovic M.V., Biehl E.R., J. Heterocycl. Chem. 1987 24 (1) 191.
22.Краснов К.А., Cлесарев В.И., Артемьева З.Л., ЖОрХ 1989 25 (12) 1553.
23.Краснов К.А., Cлесарев В.И., ЖОрХ 1997 33 (4) 601.
24.Herzig H., Hoppe-Seyler’s Z. Physiol. Chem. 1921 117 (1) 13.
25.Nevill G.A., Avdovich H.W., Can. J. Chem. 1972 50 (6) 880.
26.Краснов К.А., Cлесаревa В.И., Студенцов Е.П., ЖОрХ 1987 23 (9) 1995.
27.Краснов К.А., Cлесарев В.И., Захаров А.П., Григорьева Э.Г., ХГС 1987
(11)1523.
28.Whitehead C.W, Whitesitt C.A., Thompson A.R., J. Org. Chem. 1974 39 (5) 586.
29.Краснов К.А., Cлесарев В.И., Иванов А.Ю., Тез. Симп. по органической химии
"Петербургские встречи-95", СПб, 1995, т. 2, с. 214.
30.Maynert E.W., Dawson J.M., J. Biol. Chem. 1952 195 389.
31.Stankiewicz K., Bobranski B., Farmaco, Ed. Sci. 1978 33 740.
32.Капустина Г.В., Краснов К.А., Cлесарев В.И., ЖОрХ 1988 (24) 464.
33.Руденко Е.С., Краснов К.А., Cлесарев В.И., ЖОрХ 1989 25 (12) 2608.
34.Morsmann H.J., Helv. Chim. Acta 1935 18 1254.
35.Суворов Н.Н., Вележева В.С., Вампилова В.В., Гордеев Е.Н., ХГС 1974
(4)515.
36.Краснов К.А., ЖОрХ 2000 36 (2) 302.
37.Джумагельдыева Н., Конькова В.А., Журн. прикл. хим. 1966 39 (2) 483.
38.Shapiro S.L., Bandurco V., Freedman L., J. Org. Chem. 1962 27 174.
39.Pendergost W., J. Chem. Soc. Perkin Trans. 1 1973 2759.
40.Ивин Б.А., Дьячков А.И., Вишняков И.М. и др., ЖОрХ 1979 15 (11) 1337.
41.Москвин А.В., Петрова Н.М., Полковникова И.Н. и др., ЖОХ 1995 65 (7) 1161.
42.Haslinger E., Reithmaier M., Robien W., Wolschann P., Monatsh. Chem. 1984 115
(3)375.
43.Москвин А.В., Кульпина Г.В., Стрелкова Л.Ф. и др., ЖОрХ 1989 25 2208.
44.Краснов К.А., Карцев В.Г., Сантарович Е.Э., ХГС 2002 (5).
45.Краснов К.А., Карцев В.Г., в печати.
46.Tanaka K., Chen X., Yoneda F., Tetrahedron 1988 44 (11) 3241.
47.Minoru S., Chiruka V., Chem. Pharm. Bull. 1969 17 (4) 738.
48.Mikhopadhyaya J.K., Sklenak S., Rappoport Z., J. Org. Chem. 2000 65 6856.
49.Jursic B.S., Neumann D.M., Tetrahedron Lett. 2001 42 (48) 8435.
50.Пестов Д.В., Cлесарев В.И., Гинак А.И., Cлесарева В.И., ХГС 1988 7 952.
51.Ogura H., Sakaguchi M., Takeda K., Chem. Pharm. Bull. 1972 20 404.
52.Taylor E.C., Garcia E.E., J. Org. Chem. 1965 30 655.
53.Senda S., Hirota K., Chem. Lett. 1972 367.
54.Fenner H., Motschall H., Tetrahedron Lett. 1971 4185.
55.Kawahara N., Nakajima T., Itoh T., Ogura H., Heterocycles 1984 22 (10) 2217.
56.Kawahara N., Nakajima T., Itoh T., Ogura H., Chem. Pharm. Bull. 1985 33
(11)4740.
57.El-Hashash M.A., Mahmoud M., El-Fiky H., Rev. Roum. Chem. 1979 24 1191.
58.Fahmy A.F., Mohamed M.M., Afifi A.A., El-Hashash M.A., Rev. Roum. Chem.
1980 25 125.
59.Gogoi M., Bhuyan P., Sandhu J.S., Baruah J.N., J. Chem. Soc. Chem. Commun. 1984 1549.
Избранные методы синтеза и модификации гетероциклов, том 1 |
345 |


93.Панасюк П.М., Мельникова С.Ф., Целинский И.В., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.:
Иридиум-Пресс, 2000, т. 2, с. 228.
94.Piloty O., Finckh K., Liebigs Ann. Chem. 1904 333 52.
95.Hammerich P., Prijs B., Erlenmeyer H., Helv. Chim. Acta 1959 42 1604.
96.Ghisla S., Mayhew S.G., Eur. J. Biochem. 1976 63 373.
97.Mayhew S.G., Whitfield C.D., Ghisla S., Schuman-Jorns M., Eur. J. Biochem. 1974 44 579.
98.Васильева С.А., Калимуллина Л.Х., Такаева А.З., Сафаров М.Г., в кн.
Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2000, т. 2, с. 56.
99.Daves G.D., Robins J.R.K., J. Org. Chem. 1961 26 5256.
100.Yoneda F., Nagamatsu T., Ishiba M., J. Heterocycl. Chem. 1974 11 83.
101.Sakuma Y., Matsumoto S., Nagamatsu T., Yoneda F., Chem. Pharm. Bull. 1976 24 338.
102.Heinisch L., Ozegowski W., Muhlstadt M., Chem. Ber. 1964 97 5.
103.Ahluwalia V.K., Das U., Indian J. Chem. 1996 35B 852.
104.Hirota K., Kitade Y., Senda S., J. Heterocycl. Chem. 1985 22 345.
105.Ram V.J., V.-Berge O.A., Vietick A.J., J. Heterocycl. Chem. 1988 25 217.
106.Kienzle F., Bounameaux Y., Minder R.E., Muggli R., Helv. Chim. Acta 1986 69 1671.
107.Howarth G.A., Heterocycles 1989 29 1929.
108.Rio G., Ranjon A., Bull. Soc. Chim. Fr. 1958 2 543.
109.Stanfield J.A., Daugherty P.M., J. Am. Chem. Soc. 1959 81 5167.
110.Chande M.S., Bhandari J.D., Joshi V.R., Indian J. Chem. 1993 32B 1218.
111.Grigg R., Mitchell T.R.B., Ramasubbu A., Chem. Commun. 1979 666.
112.Bedner R., Haslunger E., Hezzig U., Polansky O.E., et al., Monatsh. Chem. 1976 107 1115.
113.Arndt A., Eistert B., Ender W., Chem. Ber. 1929 62 44.
114.Сухотин А.В., Карцев В.Г., Александров Ю.А., в печати.
115.Kende A.S., Koch K., Smith C.A., J. Am. Chem. Soc. 1988 110 (7) 2210.
116.Краснов К.А., Карцев В.Г., ЖОрХ 2002 (3) 38.
117.Краснов К.А., Карцев В.Г., Хрусталев В.Н., Изв. АН, Сер. хим. 2002 (8) 1418.
118.Krasnov K.A., Yurova M.N., Kartsev V.G., in Nitrogen-Containing Heterocycles and Alkaloids, Kartsev V.G., Tolstikov G.A., Eds., Moscow: Iridium-Press, 2001, vol. 2, p. 152.
119.Краснов К.А., Юрова М.Н., Карцев В.Г., Хим. прир. соед. 2001 6 465.
120.Краснов К.А., Карцев В.Г., Хрусталев В.Н., Изв. АН, Сер. хим. 2002, в печати.
121.Краснов К.А., Карцев В.Г., в печати.
122.Краснов К.А., Карцев В.Г., в печати.
123.Smissman E.E., Robinson R.A., Carri I.B., Boyer-Matuszak A.J., J. Org. Chem. 1970 35 3823.
124.Meltrer R.I., Lewis A.D., J. Org. Chem. 1956 21 256.
125.Knabjohann F., Doctoral (Chem.) Dissertation, Univ. Hamburg, 1977.
126.Краснов К.А., Горовой А.С., Карцев В.Г., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2000,
т. 1, с. 361.
Избранные методы синтеза и модификации гетероциклов, том 1 |
347 |

Двухстадийный синтез пирролов из кетонов и ацетиленов по реакции Трофимова
Михалева А.И., Шмидт Е.Ю.
Иркутский институт химии им. А.Е. Фаворского СО РАН 664033, Иркутск, ул. Фаворского, 1
Введение
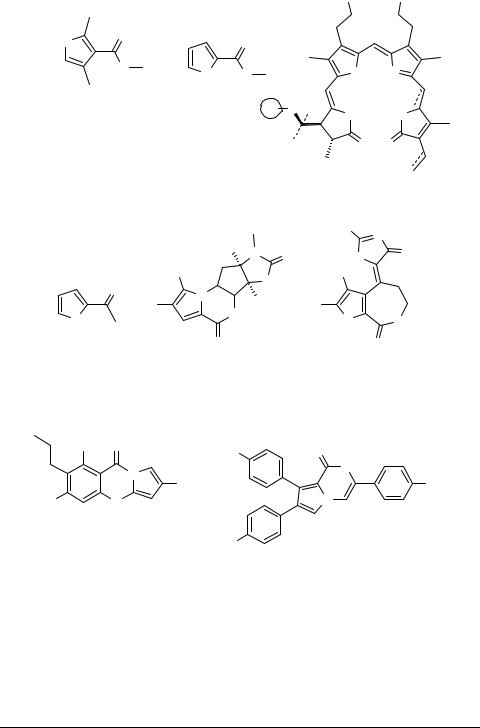
Интерес к химии пирролов не ослабевает. Исследование природных объектов приводит к обнаружению новых пиррольных соединений, среди которых присутствуют антибиотики (A), феромоны (B, C), токсины (D), ингибиторы деления клеток и иммуномодуляторы [1–3]. Пиррольные структуры входят в состав многих фундаментальных с биологической точки зрения соединений, таких как хлорофилл, гемоглобин, витамин В12, алкалоиды (E) и т.п., участвующих в фиксации солнечной энергии, процессах переноса кислорода и других жизнеобеспечивающих реакциях (F) [4–7]. Некоторые простые пирролы (в частности, 2-ацетил- пиррол) были обнаружены в летучих составляющих черного чая, японском хмеле, табачных листьях, валериане, а также в жареных зернах какао и кофе (G). В морских организмах обнаружены разнообразные полициклические вторичные метаболиты, содержащие бромпиррольные структурные элементы (H, I) [8], выделен ряд алкалоидов, имеющих в своем составе алкил- и арилзамещенные пиррольные фрагменты [9–11]. Из микробного экстракта Streptomyces rimosus выделено пиррольное соединение, пригодное для обнаружения гистидинкиназы бактерий (J) [12, 13] и обладающее грамм-положительной противомикробной активностью против устойчивых бактериальных штаммов [14]. Обнаружены полизамещенные пирролы, проявившие активность против эпидерматоидной карциномы человека (K) [15, 16]. 1,2-Диарилпирролы оказались сильными селективными ингибиторами фермента циклооксигеназы-2 (СОX-2) человека, который играет важную роль в развитии воспалительных процессов [17]. 1-Фенил-3- (аминометил)пиррол проявил высокое сродство к подтипам D2, D3, D4 допаминовых рецепторов [18]. У некоторых ароил(аминоацил)пирролов найдена антиконвульсивная активность [19].
Пирролы все шире используются в синтезе аналогов природных соединений [20] и фармацевтических препаратов [21–24].
Cl |
|
O |
|
O |
|
|
|
|
|
HN |
|
N |
N |
O |
O2N |
Cl |
|
H |
|
|
C |
|
||
A |
|
B |
|
|
антибиотик пирроленитрин |
половой феромон |
феромон |
|
|
из Pseudomonas Pyrrocinia |
бабочки Lycorea ceres |
муравья |
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
349 |
|||