
- •Методические рекомендации для самостоятельной работы студентов к занятию №10
- •Тверь, 2013
- •План изучения темы
- •Теоретические вопросы для подготовки к занятию:
- •Реакции, характерные для альдегидов
- •Реакции нуклеофильного присоединения
- •Реакции конденсации (электрофильного замещения)
- •Реакции окисления
- •Реакции полимеризации
- •Определение подлинности
- •1. Формальдегид
- •2. Хлоралгидрат
- •3. Гексаметилентетрамин
- •Количественное определение
- •Использование в медицине
- •Дайте ответы на ситуационные задачи
- •Тестовые задания по теме занятия:
- •Solutio Formaldehydi Раствор формальдегида
- •Hexamethylentetraminum Гексаметилентетрамин
- •Chloralum hydratum Хлоралгидрат
- •2,2,2 – Трихлорэтандиол – 1,1
Реакции, характерные для альдегидов
Реакции нуклеофильного присоединения
Реакции конденсации (электрофильного замещения)
Реакции окисления
Реакции полимеризации
Реакции нуклеофильного присоединения
Альдегиды вступают в реакции нуклеофильного присоединения с аммиаком и его производными (гидроксиламином, гидразином, фенилгидразином, семикарбазидом), натрия гидросульфитом, водой, спиртами, что используют в анализе и синтезе лекарственных веществ. Химическая сущность всех этих реакции – удаление молекулы воды и присоединение азота по месту двойной связи.

азометин
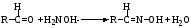
гидроксиламин оксим
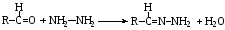
гидразин гидразон
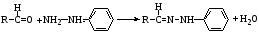
фенилгидразин фенилгидразон
Реакции конденсации (электрофильного замещения)
Известны многочисленные реакции конденсации с фенолами (резорцином, пирогаллолом, салициловой кислотой, морфином и др.) в присутствии концентрированной серной кислоты (водоотнимающее средство). При этом происходит образование окрашенных веществ.
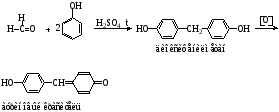
Реакция конденсации формальдегида с аммиаком лежит в основе получения гексаметилентетрамина.
Реакции окисления
Альдегиды превращаются в кислоты под влиянием сильных и слабых окислителей. Они восстанавливают из растворов солей многие металлы (серебро, ртуть, медь), особенно в присутствии щелочи. Эти реакции лежат в основе идентификации альдегидов. Наиболее известными являются реакция «серебряного зеркала», реакция с реактивом Несслера, с реактивом Фелинга (образуется кирпично-красный осадок гидроксида меди I).
Реакция «серебряного зеркала»:
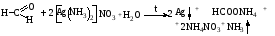
Реакция с реактивом Несслера:
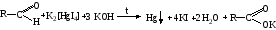
реактив Несслера
Реакция с реактивом Фелинга:
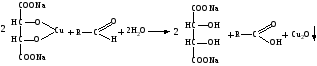
Реакции полимеризации
Примером полимеризации является реакция образования параформа из формальдегида.
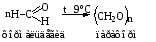
Физические свойства альдегидов зависят от химического строения. Низкомолекулярные альдегиды представляют собой газообразные вещества. Повышение молекулярной массы приводит к образованию альдегидов, являющихся жидкостями и нерастворимыми твердыми веществами. Низкомолекулярные альдегиды характеризуются резким неприятным запахом, высокомолекулярные – имеют приятный цветочный запах. Низкомолекулярные альдегиды хорошо растворяются в воде, спирте и эфире.
Наличие альдегидной группы придает веществам наркотические свойства. Кроме того, альдегиды, как и спирты, обладают антисептическим действием. Однако в отличие от спиртовой альдегидная группа усиливает токсичность вещества.
Повышает активность и токсичность альдегидов удлинение алкильного радикала, наличие непредельных связей, а также введение в молекулу галогена. Токсичность альдегидов может быть снижена образованием гидратной формы. Эта способность особенно проявляется у галогенированного альдегида.
Наркотические свойства у ацетальдегида более выражены, чем у формальдегида. Введение галогена в молекулу (хлораль) еще в большей степени повышает наркотическое действие, одновременно в той же последовательности растет и токсичность. Образование гидратной формы (хлоралгидрат) в значительной степени снижает токсичность.
В целом органические лекарственные вещества, содержащие альдегидную группу и их производные разнообразны по своей химической структуре и применению.
