
- •Ковалентная связь
- •Метод валентных связей
- •Сигма (s) и пи (p)-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •2,7 Д 2,7 д
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
Степень окисления
Трудности
определения валентности в сложных
молекулах привели исследователей к
необходимости ввести понятие о степени
окисления – величине формальной, но
легко рассчитываемой. Степенью
окисления
принято
называть условный заряд атома в молекуле,
который возникает за счет смещения
электронной плотности от менее к более
электроотрицательному атому. Степень
окисления может иметь отрицательное,
положительное и нулевое значения,
которые обычно выражают арабскими
цифрами со знаком «+» или «-» и ставят
над символом элемента. Например,

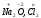
Отрицательную степень окисления имеют атомы, которые приняли электроны от других атомов, т.е. в их сторону смещено связующее электронное облако. Отрицательную степень окисления (-1) имеет атом фтора во всех своих соединениях.
Положительную степень окисления имеют атомы, отдающие свои электроны другим атомам, т.е. связующее электронное облако оттянуто от них. К таковым относятся металлы в соединениях. Степень окисления щелочных металлов равна (+1), а щелочноземельных – (+2).
Нулевую степень окисления имеют атомы в молекулах простых веществ, например водорода, хлора, азота, т.к. в этом случае связующее электронное облако в равной мере принадлежит обоим атомам. Если вещество находится в атомарном состоянии, то степень окисления его атомов также равна нулю.
В большинстве соединений атомы водорода имеют степень окисления (+1), только в гидридах металлов, например, NaH, CaH2, она равна (-1). Кислород в большинстве соединений имеет степень окисления (-2), но в соединении с фтором (F2O) она равна (+2), в пероксидах – (-1). Пользуясь этими сведениями можно вычислить степень окисления атомов в сложных соединениях, учитывая, что алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе – заряду иона.
