
- •Ковалентная связь
- •Метод валентных связей
- •Сигма (s) и пи (p)-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •2,7 Д 2,7 д
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
Полярные и неполярные молекулы
Различают две разновидности ковалентной связи: неполярную и полярную. В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: H2, Cl2, O2, N2, F2 и другие, в которых электронная пара в одинаковой мере принадлежит обоим атомам. В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: HCl, H2O, H2S, NH3 и другие.
Относительная электроотрицательность атомов
|
Н 2,1 | ||||||
|
Li 1,0 |
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
|
Na 0,9 |
Mg 1,2 |
Al 1,5 |
Si 1,8 |
P 2,1 |
S 2,5 |
Cl 3,0 |
|
K 0,8 |
Ca 1,0 |
Ga 1,6 |
Ge 1,8 |
As 2,0 |
Se 2,4 |
Br 2,8 |
|
Rb 0,8 |
Sr 1,0 |
In 1,7 |
Sn 1,8 |
Sb 1,9 |
Te 2,1 |
J 2,5 |
Электрические центры положительных и отрицательных зарядов в молекуле не совпадают в одной точке, а находятся на некотором расстоянии ℓ.
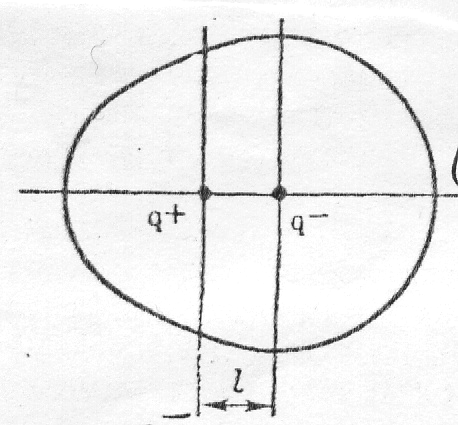
Полярная молекула с постоянным электрическим моментом диполя
Молекула при общей нейтральности представляет собой электрический диполь с зарядом q- – у атома хлора и q+ - у атома водорода. Такие связи и молекулы называются полярными. Заряды атомов в молекуле q называются эффективными зарядами (в молекуле HCl qcl = -0,18; а qн = +0,18 абсолютного заряда электрона, степень ионности связи
18 %).
Мера полярности связи и молекулы – электрический момент диполя (μ – «мю») определяется произведением
μ = qℓ, Кл∙м или μ = qℓ/3,33∙10-30, Д
где q – эффективный заряд; ℓ - длина диполя. Единица электрического момента диполя (система СИ) выражается значением 3,33∙10-30 Кл∙м (кулон-метр) = 1Д (Д - Дебай).
Электрический момент диполя – векторная величина. Направление его условно принимают от положительного заряда к отрицательному – в сторону смещения связующего электронного облака. Чем больше разность электроотрицательностей элементов в полярных молекулах, тем больше электрический момент диполя.
Для многоатомных молекул следует различать понятия о дипольных моментах отдельных связей и молекулы в целом. Поскольку при наличии нескольких связей в молекуле их дипольные моменты складываются по правилу параллелограмма, то в зависимости от формы молекулы, определяемой направленностью связей, результирующий дипольный момент отличается от дипольных моментов отдельных связей и в частном случае (для высокосимметричных молекул) может быть равен нулю, несмотря на значительную полярность отдельных связей. Например, линейная молекула СО2 неполярна (μ = 0), хотя каждая связь С=О имеет значительный дипольный момент (μ = 2,7 Д).
-δ +2δ -δ
О == С == О
2,7 Д 2,7 д
Молекулы, содержащие неполярную ковалентную связь, называются неполярными или гомеополярными. У таких молекул связующее электронное облако распределяется симметрично между ядрами обоих атомов, и ядра в равной мере действуют на него. Примером могут служить молекулы простых веществ, состоящие из атомов одного элемента: H2, Cl2, O2, N2, F2 и другие. Электрический момент диполя таких молекул равен нулю.
Способность молекул (и отдельных связей) поляризоваться под влиянием внешнего электрического поля называется поляризуемостью. Это может происходить и под влиянием поля, создаваемого приблизившейся полярной молекулой. Поэтому поляризуемость имеет большое значение в химических реакциях.
Всегда важно учитывать полярность молекулы и ее электрический момент диполя. С последним связана реакционная способность веществ. Как правило, чем больше электрический момент диполя молекулы, тем выше реакционная способность вещества. С электрическим моментом диполя связана также и растворимость веществ. Полярные молекулы жидкостей благоприятствуют электрической диссоциации растворенных в них электролитов по принципу «подобное растворяется в подобном».
