
posobie
.pdf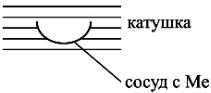
2. Высокочастотный индукционный нагрев. Метод синтеза НЧ с по-
мощью плазмы, создаваемой радиочастотным нагревом катушки (рис. 2.3). Металл находится в откачиваемой камере. В процессе Me разогревается выше точки испарения. Затем в систему впускается гелий. Образуется высокотемпературная плазма. Атомы гелия выступают в качестве зародышей для атомов Me, и эти комплексы диффундируют к холодному коллектору, где и образуются НЧ. Для стабилизации вводят пассивный газ (O2 для Al).
Рис. 2.3. Схема установки для получения наночастиц с помощью плазмы, разогреваемой высокочастотным полем
3. Испарение и газовая агрегация. Испаряется твердое тело или жидкость в холодный газ, который охлаждает испаряемые атомы до их конденсации в кластере
Cu + Cu + Ar →Cu2 + Ar. |
(2.1) |
Образованный димер может разрушиться или расти далее.
Кластеры могут получаться с помощью дугового разряда между двумя угольными электродами в атмосфере гелия. На специальном приёмнике собирается сажа, которая затем растворяется в органических растворителях с последующим выделением фуллеренов (C60).
4. Метод лазерного электродиспергирования (ЛЭД). Метод основан на использовании абляции металлической мишени под воздействием мощного импульсно-периодического лазера. Для нанесения металлических покрытий путем лазерной абляции обычно выбирают режимы облучения мишени, позволяющие максимально эффективно переводить материал мишени в паровую фазу и формировать на подложке наноструктуры из испаренного вещества. В плазме с электронной температурой 20–30 эВ жидкие капли металла заряжаются до критической величины, при которой они становятся неустойчивыми и начинают делиться. Причиной является превосходство сил кулоновского расталкивания над силами поверхностного натяжения. При достижении порога неустойчивости капля теряет сферическую форму и начинает делиться, порождая множество более мелких (дочерних) капель. Деление носит каскадный характер, при этом на каждой ступени каскада размер капель уменьшается приблизительно в 10 раз. При уменьшении размера капель возрастает электрическое поле на их поверхности, что приводит к увеличению тока полевой эмиссии электронов.
21

При размере капель в несколько нанометров поток электронов с их поверхности становится больше, чем поток поступающих из плазмы электронов, капли становятся устойчивыми, и их дальнейшее деление прекращается. Таким образом, в результате деления микронных и субмикронных капель в плазме лазерного факела формируется огромное количество нанометровых частиц с узкой дисперсией размера и небольшое количество остатков материнских капель, не успевших полностью разделиться. Размер наночастиц при заданных электрофизических параметрах системы является функцией лишь природы металла.
Полная схема формирования наноструктур методом лазерного электродиспергирования представлена на рис. 2.4. Для дополнительной сепарации образовавшихся заряженных частиц в зазоре между мишенью и подложкой приложено неоднородное стационарное электрическое поле. Конфигурация и величина электрического поля выбираются таким образом, чтобы сфокусировать нанометровые капли на подложку, не возмущая при этом движение более крупных частиц. Поверхностная плотность частиц и число слоев гранул контролируется выбором времени нанесения пленки.
Рис. 2.4. Процесс формирования плёнок наночастиц методом ЛЭД [Ростовщикова Т.Н., Смирнов В.В., Кожевин В.М., Явсин Д.А., Гуревич С.А. Межкластерные взаимодействия в катализе наноразмерными частицами // Российские нанотехнологии. 2007. Т. 2, № 1–2. С. 47–60]
В пользу описанного процесса деления микрокапель свидетельствуют результаты, полученные при расположении подложки в непосредственной близости от поверхности медной мишени (менее 0.5 см). Как видно из рис. 2.5, после облучения мишени поверхность подложки покрывается микрочастицами субмикронного размера, часть которых имеют выступы размером приблизительно в 10 раз меньше размера основных частиц. Наличие таких частиц с выступами можно трактовать как следствие осаждения на подложку делящихся капель, процесс деления которых был прерван из-за контакта с подложкой. В то же время, как видно из рис. 2.6а и 2.6б, на подложке, удаленной от мишени на расстояние около 5 см, находятся только наночастицы, средний размер которых равен 5 нм.
22

Рис. 2.5. Микрофотография поверхности подложки, установленной вблизи медной мишени [Ростовщикова Т.Н., Смирнов В.В., Кожевин В.М., Явсин Д.А., Гуревич С.А. Межкластерные взаимодействия в катализе наноразмерными частицами // Российские нанотехнологии. 2007. Т. 2, № 1–2. С. 47–60]
а |
б |
Рис. 2.6. Микрофотография наночастиц меди на подложке SiO2/Si: а – время нанесения 1 мин; б – время нанесения 5 мин.
[Ростовщикова Т.Н., Смирнов В.В., Кожевин В.М., Явсин Д.А., Гуревич С.А. Межкластерные взаимодействия в катализе наноразмерными частицами // Российские нанотехнологии. 2007. Т. 2, № 1–2. С. 47–60].
2.3. Химические методы получения НЧ
Химические методы получения наночастиц являются самыми полезными в крупномасштабных производствах.
1. Химическое восстановление. Отличает простота и доступность. Ионы металла Меz+ восстанавливаются под действием восстановителя Red:
Mez+ +Red → Me+Ox |
|
_____________________ |
(2.2) |
Mez+ +ze- → Me (восстановление) |
Red → Ox+ze- (окисление)
Поведение металлической частицы в растворе в общем случае определяется разностью потенциалов E = EMez+  Me − EOx/Red , где EMez+
Me − EOx/Red , где EMez+  Me – равновесный
Me – равновесный
окислительно-восстановительный потенциал металлической частицы, EOx/Red – соответствующий потенциал раствора восстановителя. При ∆E > 0
наблюдается рост частиц, при ∆E < 0 – их растворение.
23
Для получения высокодисперсных металлических порошков и золей весьма существенно, чтобы разность ∆Е между редокс-потенциалами восстановителя и восстанавливаемого металла была достаточно велика. Это условие позволяет обеспечить высокую скорость протекания реакции и создать благоприятные условия для образования большого числа зародышей новой фазы уже на ранних этапах получения продукта. В качестве восстановителей используются NaBH4, N2H4, Na2S2O4, H2 и другие, часто органические, вещества.
Химическое взаимодействие в системе восстанавливаемый ион металла – восстановитель может быть связано с переносом электрона от восстановителя к иону металла через образование промежуточного комплекса, которое снижает энергию переноса электрона. Возможен механизм, тоже связанный с переносом электрона, но имеющий место при непосредственном участии поверхностного слоя растущей частицы металла. Подобный механизм назван электрохимическим.
Пример. Тетраборат щелочного металла. Восстановление происходит с участием комплексов с мостиковыми связями Me…H…B, образование которых способствует последующему переносу атома H и разрыву мостиковой связи, окислительно-восстановительному переносу e–, разрыву связи B– H с образованием BH3. Полученный боран гидролизуется или каталитически разрывается на поверхности частиц Ме:
BH3 |
+3H2O → B(OH)3 +3H2 |
(2.3) |
|||
BH |
+Me → B+ 3 H |
+Me |
|||
|
|||||
3 |
2 |
2 |
|
|
|
Восстановление металлов органическими соединениями. |
|
||||
Cu2+ +2HCHO+4OH- → Cu0 +2HCOO- +H2 +2H2O . |
(2.4) |
||||
Формальдегид дополнительно защищает ионы меди лигандами – соединениями с карбоксильными или гидроксильными группами. Весьма неожиданный способ получения устойчивого Ag-коллоида: восстановление AgNO3 сольватированными электронами, источником которых является, например, растворимый в жидком аммиаке натрий. Предполагается, что катионы Na в этих условиях играют роль стабилизирующего агента.
2. Термохимический метод (реакция термического распада). Форми-
рование металлов из азидов.
2LiN3 |
→2Li+3N2 |
(2.5) |
|
t |
|
Вещество помещается в кварцевую трубку и нагревается до 400 °С. При 370 °С азид разлагается с выделением газа N2 (рис. 2.7). Откачивается N2. Оставшиеся атомы Li объединяются в маленькие частицы размером ≈5 нм.
24

Рис. 2.7. Установка для получения наночастиц металла путем термического разложения твердого вещества
При термолизе формиатов, оксалатов
Me(HCOO)n =Me +0.5nH2 + nCO2 |
(2.6) |
образуются электронно-плотные НЧ, по форме близкие к сферическим с узким распределением по размерам (рис. 2.8). Данные электронной микроскопии (ЭМ) совпадают с размерами, рассчитанными по удельной поверхности S твердых продуктов распада, что позволяет считать эти частицы плотными некристаллическими образованиями (табл. 2.1).
Рис. 2.8. Распределение по размерам электронно-плотных частиц продуктов распада
Средний размер частиц по данным ЭМ |
Таблица 2.1 |
||||||
|
|
||||||
Соединение |
T, К |
|
d |
, нм |
|
Продукт |
|
S |
|
|
ЭМ |
|
|||
|
|
|
|
|
|
||
Cu(HCOO)2 |
413 |
30 |
|
|
30 |
|
Cu |
Cu(HCOO)2 · МЭА |
398 |
- |
|
|
69–75 |
|
Cu |
Cu(N2H3COO)2 · 2H2O |
353 |
- |
|
|
200–300 |
|
Cu |
Ni(HCOO) 2 · 2H2O |
483 |
30 |
|
|
30 |
|
Ni |
Примечание: МЭА – моноэтаноламин.
Наиболее важная проблема при получении НЧ состоит в управлении синтезом, т.е. целенаправленная конкуренция между процессами зарождения и роста частиц. Создание научных основ управление синтезом НЧ – од-
25
на из фундаментальных задач в области физикохимии ультрадисперсных систем. Актуальна задача поиска путей формирования НЧ с узким распределением по размерам.
Не менее важной проблемой при получении НЧ является стабилизация образующихся высокодисперсных частиц, которая тесно связана со способами её осуществления. В процессе термолиза происходит рост НЧпродуктов и увеличение их средних размеров. Так, ЭМ-наблюдения продуктов разложения Cu(HCOO)2 в процессе превращения (степень превращения ~ 0.1) в матрице разлагающегося вещества образуются частицы металлической меди с формой, близкой к сферической, и размерами dЭМ ≈ 20– 100 нм. С увеличением степени превращения до ~ 0.2 их средний размер возрастает до dЭМ ≈ 200 нм. В общем, при термолизе, как правило, получаются частицы ≈ 10–100 нм.
3. Фотохимические методы. Восстановление происходит в реакциях, стимулируемых высокоэнергетическим излучением. Сильные восстановители: e-, атомы, радикалы, нестабильные возбужденные частицы. Под действием света имеет место последовательное присоединение фотоэлектронов к междоузельным ионам в AgBr по схеме:
Ag+ +e- → Ag |
|
|
1 |
|
|
Ag +Ag+ → Ag+ |
|
|
1 |
2 |
|
Ag2+ +e- → Ag3 |
. |
(2.7) |
−−−−−−−−− |
|
|
Ag+n +e- → Agn
Промежуточным продуктом при радиационно-химическом методе восстановления (радиолизе) являются e-, ионы, возбужденные частицы. Вслед за быстрым одноэлектронным восстановлением ионов Me происходит их диспропорционирование с образованием простых атомных и ионных кластеров ( Ag+2 , Ag2, Ag2+4 , Ag+4 и других), либо кластеров и интермедиатов (в
случае образования медных коллоидов в присутствии формиат-ионов
CuCO2, Cu+, Cu+2 ).
Cu |
2+ |
CO-2 ,eaq− |
Cu2+ |
+ |
xCu+ |
m+ |
→Cuколл . |
(2.8) |
|
→CuCO2 |
→Cu2 |
→Cu j |
|||||
|
|
|
|
|
2 |
|
|
|
4. Лазерно-химические методы (рис. 2.9). Для получения НЧ Ag ис-
пользуют импульсный лазер. Раствор нитрата серебра и восстановителя протекал через смеситель, представляющий собой диск, вращающийся в растворе. Нитрат серебра реагировал с восстановителем в горячих областях с образованием НЧ Ag, выделяемых впоследствии из раствора в центрифуге. На размер частиц можно влиять энергией лазерного луча и скоростью вращения диска.
26

Рис. 2.9. Установка для получения наночастиц серебра импульсным лазерным методом
5.Криохимический метод. Конденсация атомов Me в матричную систему или соконденсация соединений, выполняющих функцию матрицы, с парами Me на охлаждаемую поверхность (матрицы – генерируемые газы, бензол, этанол, органические растворители).
Высокая активность атомов и малых кластеров металлов в отсутствие стабилизаторов обуславливает агрегацию в более крупные частицы. Процесс агрегации атомов металлов идет практически без энергии активации. Стабилизацию активных атомов почти всех элементов периодической системы удалось осуществить при низких (77 К) и сверхнизких (4– 10 К) температурах методом матричной изоляции. Суть этого метода состоит в применении инертных газов при сверхнизких температурах. Чаще всего в качестве матриц используются аргон и ксенон. Пары атомов металлов конденсируют с большим, обычно тысячекратным, избытком инертного газа на поверхность, охлаждаемую до 10–12 К. Значительное разбавление инертным газом и низкие температуры практически исключают возможность диффузии атомов металлов, и в конденсате происходит их стабилизация.
6.Электрохимические методы. Электрокристаллизация Me из растворов – выделение на катоде Me или сплавов:
Mez+ +ze- → Me. |
(2.9) |
Введение в электролит стабилизаторов (ПАВ) приводит к образованию в растворе НЧ. Анодом служит объемный образец Me, переводимый в Meкластеры, которые формируются в области катода; катодом служит либо тот же металл, либо другой Me (рис. 2.10).
27

Рис. 2.10. Принципиальная схема электрохимического получения индивидуальных металлических наночастиц
В состав электролитического раствора, наряду с проводящими органическими соединениями входят ПАВ, которые в данной ситуации, повидимому, выполняют двоякую роль, а именно: наряду со стабилизацией образующихся НЧ они, адсорбируясь на катоде, экранируют активные места его поверхности, препятствуя тем самым выделению осадка металла.
Одним из перспективных научных направлений является использование электрохимического синтеза для конструирования наноструктурных материалов. Суть его заключается в формировании в ходе кинетически контролируемого электровосстановления двумерных (ленгмюровских) монослоев металлических НЧ под монослойными «матрицами» ПАВ, находящимися на поверхности электролитического раствора, в циркулярной электрохимической ячейке. Такая ячейка применительно к электрохимическому получению наночастиц Ag представляет собой круговой желоб с электролитическим раствором, содержащим ионы Ag+, в котором плавают массивный (диаметр 1 мм) серебряный анод и платиновый микрокатод, находящийся на поверхности раствора в середине желоба (рис. 2.11). Частицы серебра образуются лишь тогда, когда монослой ПАВ несет отрицательный заряд.
Рис. 2.11. Принципиальная схема электрохимического получения монослоев металлических наночастиц
28

Частицы Ag размером 2–7 нм получены электрохимическим растворением пластины серебра, являющейся анодом, в апротонном растворе, например ацетонитриле. При использовании Pt-катодов образуются сферические НЧ Ag. На катоде из Al формируются и осаждаются только плёнки
(рис. 2.12).
Рис. 2.12. Схема, иллюстрирующая конкуренцию двух процессов:
1 – образование частиц Ag; 2 – осаждение частиц и формирование плёнки
Достоинством электрохимического синтеза является экспериментальная доступность и возможность контроля и управления процессом получения наночастиц.
3. СТАБИЛИЗАЦИЯ НАНОРАЗМЕРНЫХ ЧАСТИЦ. НАНОКОМПОЗИТЫ
3.1. Методы стабилизации НЧ
Ранее было сказано, что НЧ – это энергонасыщенные системы. Запасенная энергия определяется в первую очередь нескомпенсированностью поверхностных и приповерхностных связей.
У очень маленьких частиц почти все атомы находятся на поверхности. Колебания поверхностных атомов, ограниченных соседями, слабее, чем колебания внутренних, так что они могут сильнее отклоняться от своих равновесных положений. Это приводит к изменениям в структуре (со временем). Так, с помощью электронной микроскопии наблюдали за изменением кластеров Au во времени. Кластеры золота размером 1–10 нм создавались в вакууме и осаждались на Si-подложку, которая затем покрывалась пленкой SiO2. Четко прослеживаются флуктуационные изменения структуры в направлении формирования агрегатов атомов, похожих на каплю жидкости.
29
НЧ – метастабильные, но долгоживущие структуры. Существует критический размер, при котором они становятся устойчивыми и больше не испытывают существенного испарения. Таким образом, есть начальная стадия формирования островков, когда их число с добавлением новых порций материала увеличивается. За ней следует вторая, в течение которой количество островков стабилизируется, а существующие островки растут в размере. Наконец, есть стадия слияния, когда островки объединяются с образованием больших кластеров.
Стабилизация НЧ – необходимая стадия. Выделяют:
1.Газофазные безлигандные кластеры.
2.Лигандные кластеры.
3.Коллоидные кластеры.
4.Твердотельные кластеры.
5.Матричные кластеры.
6.Нанопленки.
1.Газофазные безлигандные кластеры. Получаются лазерным испаре-
нием. Используют высокочастотное магнитное поле. Применение подложки необходимо, поскольку НЧ очень активны и при столкновении агрегируют. Подложка играет роль стабилизатора.
2.Лигандные кластеры. Молекулярные лигандные кластеры Ме – это многоядерные комплексные соединения. Остов металла (из нескольких атомов, непосредственно связанных между собой). Кластеры образуются в результате химических реакций.
3.Коллоидные кластеры. Золь-гель технология. Так, при гидролизе солей Ме или алкалоидов Ме образуются золи оксидов и гидроксидов Ме, которые характеризуются большим избытком энергии. Происходит агрегирование золей с образованием гелей. В последнее время стали использовать микроэмульсионные системы (прямые и обратные мицеллы).
4.Твердотельные кластеры. Твердотельные кластеры формируются в результате химических реакций, переходя из аморфной фазы в кристаллическую фазу, в ходе механохимических превращений. Многие химические реакции в твердом теле, например, реакции термического разложения солей
икомплексов Ме, сопровождаются образованием зародышей Ме или их оксидов и последующим их ростом за счет спекания.
5.Матричные кластеры. Пропитка пористых матриц и проведение химических реакций в порах как в нанореакторах. Цеолиты. Ионообменные смолы. Размер кластеров определяется не только размером пор, но и гидрофильностью, концентрацией реагентов.
6.Нанопленки. Используют методы испарения, молекулярного наслаи-
вания.
30
