
- •Реакции алифатического нуклеофильного замещения[ Реакции sn1[
- •Способы получения галогеналканов
- •Этиленгликоль
- •Глицерин
- •Изомерия[править | править исходный текст]
- •Физические свойства
- •1. Образование фенолятов
- •Фенетол
- •3. Образование сложных эфиров фенолов
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
Изомерия[править | править исходный текст]
Возможны 2 типа изомерии:
изомерия положения заместителей в бензольном кольце;
изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком!
36. Реакции гидроксила фенолов
1. Образование фенолятов

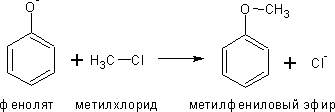
2. Образование простых эфиров фенолов взаимодействием фенолятов с галоидными алкилами или диметилсульфатом (СН3-О-SO2-O-CH3)
37.
Реакции фенолов
Фенолы
могут реагировать как по гидроксильной
группе, так и по бензольному кольцу.
1.
Реакции по гидроксильной
группе
Углерод-кислородная
связь в фенолах гораздо прочнее, чем в
спиртах. Например, фенол не может быть
превращен в бромбензол действием на
него бромоводорода, тогда как циклогексанол
при нагревании с бромоводородом легко
превращается в бромциклогексан:
 (22)
Как
и алкоксиды феноксиды реагируют с
алкилгалогенидами и другими алкилирующими
реагентами с образованием смешанных
эфиров:
(22)
Как
и алкоксиды феноксиды реагируют с
алкилгалогенидами и другими алкилирующими
реагентами с образованием смешанных
эфиров:
 (23)
(23)
Фенетол
 (24)
(24)
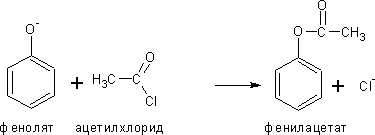
3. Образование сложных эфиров фенолов
Не может быть проведено взаимодействием с кислотами, проводят реакцией фенолятов (в щелочной среде) с галогенангидридами или ангидридами кислот:
4. Реакция фенола с галоидами фосфора вместо замещения гидроксила на галоген приводит к образованию эфиров фосфористой (если реагирует с PCl3) или фосфорной (если реагирует с PCl5) кислот:

(трифенилфосфит)
5. При перегонке с цинковой пылью фенолы превращаются в углеводороды (бензол).
38. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:

Многоатомные спирты. Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения.
Общим методом синтеза гликолей является окисление алкенов перманганатом калия в нейтральной или щелочной среде.
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. Однако в их химических свойствах есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют с щелочами, образуя соли. По аналогии с алкоголятами соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Этареакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода —СН(ОН)—СН(ОН)—:

Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин):

Фенолы. Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название “фенол”. Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров — орто-, мета- и пара-крезолов.
Физические свойства. Фенолы в большинстве своем — кристаллические вещества (мета-крезол — жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в воде, но хорошо растворяются в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения.
Способы получения.
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
![]()
2. Получение из ароматических сульфокислот (см. реакцию 3 в разделе “Химические свойства бензола”), реакция проводится при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:

Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):

Среди антисептических средств, широко применяемых в современной медицине, это вещество занимает значимое место. Применение фенола обусловлено его бактерицидными свойствами. Кислота карбоновая (фенол) получается путем перегонки каменоугольного дегтя. Чистая кислота карбоновая – бесцветная кристаллическая масса. Под действием воздуха она постепенно приобретает розовый оттенок. Применение фенола облегчается тем, что это вещество легко растворяется в воде, эфире, спирте и жирных маслах. Его растворы оказывают хорошее бактерицидное действие по отношению к микроорганизмам (вегетативной форме) и грибам. Слабое влияние они оказывают на споры микроорганизмов. Взаимодействуя с белком клеток микроорганизмов, фенол вызывает его денатурацию, повышает проницаемость мембран клеток, оказывает воздействие на окислительные процессы в клетке. Бактерицидный эффект при повышении температуры и в кислой среде усиливается
39. Среди функциональных производных карбоновых кислот особое место занимают сложные эфиры — соединения, представляющие карбоновые кислоты, у которых атом водорода в карбоксильной группе заменен углеводородным радикалом. Общая формула сложных эфиров
|
R - C - O - R' |
|
|| |
|
O |
где R и R' — углеводородные радикалы (в сложных эфирах муравьиной кислоты R — атом водорода).
Названия сложных эфиров производят от названия, углеводородного радикала и названия кислоты, в котором вместо окончания "-овая кислота" используют суффикс "ат", например:
|
|
| ||||||||||||||||||||||||
Часто сложные эфиры называют по тем остаткам кислот и спиртов, из которых они состоят. Так, рассмотренные выше сложные эфиры могут быть названы: этановоэтиловый эфир, кротоновометиловый эфир.
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи, начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например:
|
|
| ||||||||||||||||||||||||
|
|
| ||||||||||||||||||||||||
2. Изомерия положения сложноэфирной группировки -СО-О-. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например:
|
СН3-СО-О-С2Н5 |
|
С2Н5-СО-О-СН3 |
|
этилацетат |
|
метилпропионат |
3. Межклассовая изомерия, например:
|
СН3-СО-О-СН3 |
|
С2Н5-СО-ОН |
|
метилацетат |
|
пропионовая кислота |
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи; цис-транс-изомерия.
Физические свойства сложных эфиров. Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, малорастворимые или практически нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т.д.
Сложные эфиры имеют, как правило, более низкую температуру кипения, чем соответствующие им кислоты. Например, стеариновая кислота кипит при 232 °С (Р = 15 мм рт. ст.), а метилстеарат— при 215 °С (Р =15 мм рт. ст.). Объясняется это тем, что между молекулами сложных эфиров отсутствуют водородные связи.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы, хорошо растворимы в органических растворителях. Например, пчелиный воск представляет собой в основном мирицилпальмитат (C15H31COOC31H63).
40. В химическом отношении простые эфиры характеризуются высокой инертностью по отношению ко многим реагентам, особенно основной природы. Они не расщепляются металлоорганическими соединениями, гидридами и амидами щелочных металлов, а также комплексными гидридами бора и алюминия. Простые эфиры практически незаменимы в качестве растворителей при получении магнийорганических и других металлоорганических соединений, а также для реакций восстановления алюмогидридами и его производными. Сольватирующая способность эфиров как растворителей основана на их свойствах жестких оснований Льюиса. Эфиры образуют очень прочные комплексы с жесткими кислотами Льюиса - BF3, AlBr3, AlR3, SbCl5, SbF5, SnCl4, ZnCl2 и т.д. состава 1:1 или 2:1.

Как основания Льюиса простые эфиры образуют комплексы с галогенами, в которых эфир играет роль донора, а галоген акцептора. Раствор иода в эфире окрашен в коричневый цвет в отличие от фиолетовой окраски иода в растворах в алканах.
![]()
Сдвиг максимума поглощения при комплексообразовании позволяет оценить прочность комплекса. Кроме того в ультрафиолетовой области появляется новая полоса поглощения, называемой полосой переноса заряда. Такие комплексы получили название комплексов с переносом заряда (КПЗ). Эфиры образуют соли триалкилоксония при взаимодействии с очень сильными алкилирующими агентами.

Триэтилоксонийборфторид легко получается при взаимодействии эфирата трехфтористого бора с эпихлоргидрином в абсолютном эфире.
![]()

В настоящее время соли триалкилоксония получают при взаимодействии простых эфиров с алкилтрифлатами или алкилфторсульфонатами. Катион триалкилоксония - сильнейший алкилирующий агент почти для любого, даже слабого нуклеофильного агента.

На способности простых эфиров давать соли оксония основаны способы расщепления простых эфиров под действием бромистоводородной или иодистоводородной кислот, а также тригалогенидов бора.
|
[предыдущий раздел] |
[содержание] |
[следующий раздел] |
