
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ДОНСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра физики
Изучение спектра атома водорода. Определение постоянной ридберга
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ №4 ПО ФИЗИКЕ
(раздел «Атомная физика»)
Ростов-на-Дону 2012
УДК 530.1
Составители: доц. И.В. Мардасова
доц. Н.В. Пруцакова
доц. А.Я. Шполянский
Изучение спектра атома водорода. Определение постоянной Ридберга: метод. указания к лабораторной работе № 4. – Ростов н/Д: Издательский центр ДГТУ, 2012 – 12 с.
Указания содержат краткие сведения о боровской теории водородоподобного атома, спектральном методе исследования и порядок выполнения лабораторной работы.
Методические указания предназначены для выполнения лабораторной работы студентами всех форм обучения в лабораторном практикуме по физике (раздел «Атомная физика»).
Печатается по решению методической комиссии факультета «Нанотехнологии и композиционные материалы»
Научный редактор канд. ф.-м. наук, проф. Наследников Ю.М.
© Издательский центр ДГТУ, 2012
Издательский центр ДГТУ, 2012
Лабораторная работа №4
Цель работы: изучение спектрального метода исследования веществ с использованием спектроскопа; определение длин волн спектральных линий атома водорода; расчет постоянной Ридберга.
Приборы и оборудование: монохроматор УМ-2, работающий в режиме спектроскопа; конденсор; неоновая лампа; ртутная лампа ДРШ; водородная трубка; высокочастотный генератор.
Краткая теория
Спектральный анализ – это физический метод определения качественного и количественного состава вещества на основе изучения его спектров. Совокупность частот (или длин волн), содержащихся в излучении вещества, называется спектром испускания данного вещества.
Спектр излучения отдельных атомов состоит из отдельных спектральных линий - линейчатый спектр. Молекулярные спектры в отличие от атомных представляют собой набор полос – полосатый спектр.
В задачу данной работы входит изучение линейчатого спектра испускания водорода в газообразном состоянии с помощью спектроскопа.
Как же возникает линейчатый спектр излучения отдельных атомов водорода? Прежде всего происходит диссоциация молекул на атомы в газовом разряде в результате столкновений свободных электронов с молекулами. Далее соответствующие столкновения свободных электронов с атомами обуславливают переход электрона в атоме на более высокие энергетические уровни. Такое состояние атома или молекулы, возникающее при рекомбинации атомов, не является устойчивым, через время ~10-8 с электрон вернется на свой энергетический уровень, и атом или молекула испустят квант света - фотон. Основным будет линейчатый спектр испускания атомов водорода, на который может частично накладываться менее интенсивный полосатый спектр молекул водорода.
Согласно второму постулату Бора, энергия фотона, который испускается при переходе электрона в атоме из состояния с номером m в состояние с номером n, равна
![]() ,
,
![]()
или
![]() (1)
(1)
где
![]() – постоянная Планка,
– постоянная Планка,![]() – частота излучения,
– частота излучения, ![]() –
длина
волны,
–
длина
волны,
![]() –
скорость
света в вакууме,
–
скорость
света в вакууме,![]() – энергии m
-
го
и
n
-
го
состояний соответственно.
– энергии m
-
го
и
n
-
го
состояний соответственно.
Из квантовой механики следует, что энергии электронов в атомах могут принимать только определенные дискретные значения. Состояния, отвечающие этим значениям энергии, называются энергетическими уровнями. При переходе электронов на более низкие уровни излучаются спектральные линии. Совокупность линий, отвечающих переходам с различных более высоких уровней на один и тот же нижний уровень, образует спектральную серию.
Наиболее простой является система энергетических уровней атома водорода. Значение энергий электрона в атоме водорода можно вычислить по формуле:
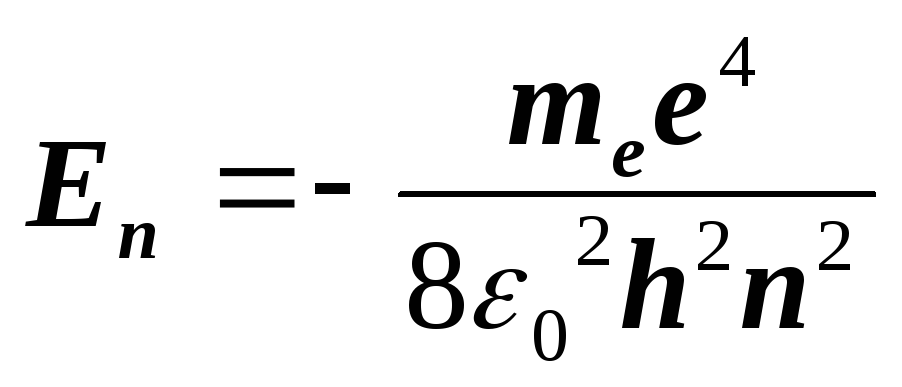 (n=1,
2, 3…), (2)
(n=1,
2, 3…), (2)
где
n
–
главное
квантовое
число,
![]() –
масса
электрона,
–
масса
электрона,
![]() –
заряд
электрона,
–
заряд
электрона,
![]() – электрическая постоянная. Формула
(2) впервые получена Н. Бором. Для более
сложных атомов эта формула несправедлива.
– электрическая постоянная. Формула
(2) впервые получена Н. Бором. Для более
сложных атомов эта формула несправедлива.
Из (1) и (2) следует, что длины волн спектральных линий атома водорода могут быть рассчитаны по формуле:
![]() , (3)
, (3)
где
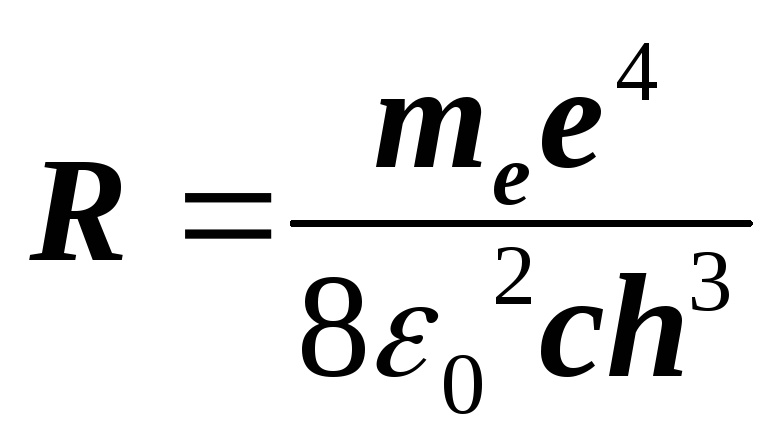 (4)
(4)
– константа, называемая постоянной Ридберга. Формула (3) называется обобщенной формулой Бальмера.
Из формулы (3) следует, что линии в спектре атома водорода можно расположить по сериям. Для всех линий одной и той же серии значение n остается постоянным, а m может принимать любые целые значения, начиная с (n + 1).
В
данной работе изучается серия
Бальмера
– совокупность линий в спектре атома
водорода, соответствующих переходам
со всех вышележащих уровней на уровень
с n
= 2. Только
при n
= 2 и m
= 3, 4, 5, 6 излучаемые фотоны имеют длину
волны ![]() ,
попадающую в видимый
участок спектра. При других значениях
n
и m
фотоны соответствуют инфракрасному
или ультрафиолетовому участкам спектра.
,
попадающую в видимый
участок спектра. При других значениях
n
и m
фотоны соответствуют инфракрасному
или ультрафиолетовому участкам спектра.
Длины
волн ![]() фотонов
видимого участка могут быть вычислены
по
формулам:
фотонов
видимого участка могут быть вычислены
по
формулам:
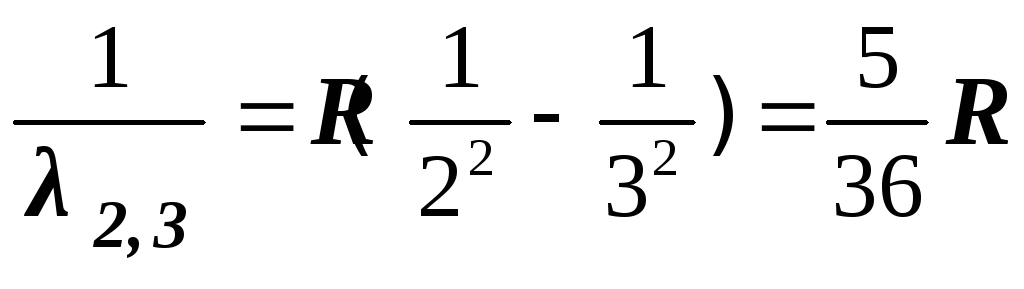
 – красная линия
– красная линия
(5)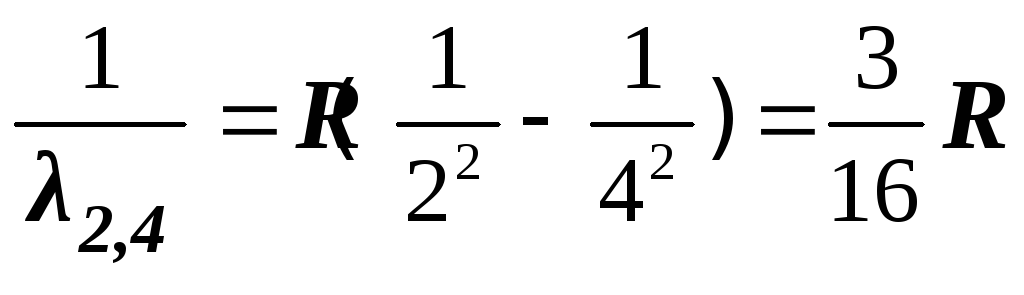
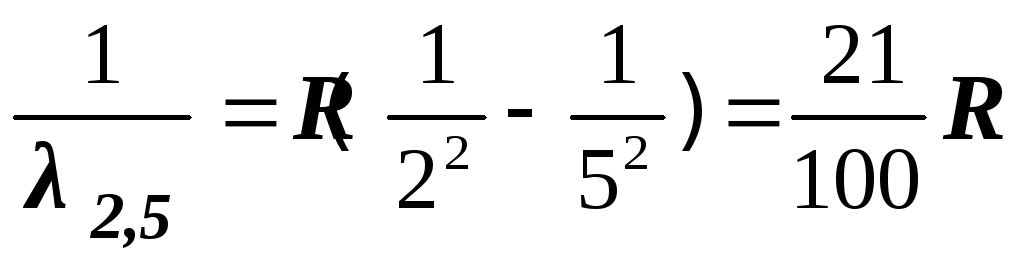 – фиолетово-синяя линия
– фиолетово-синяя линия
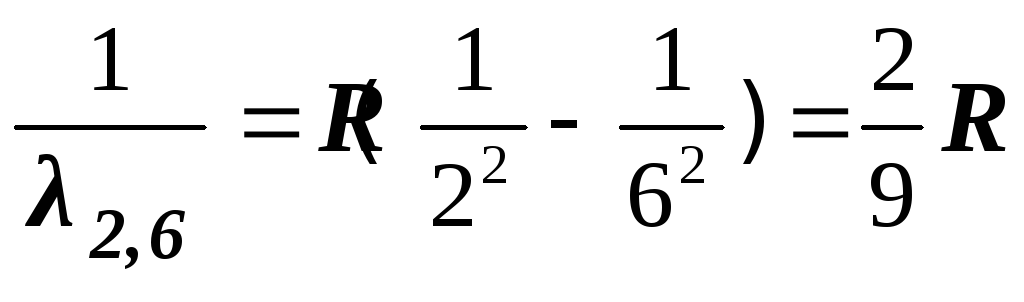 – фиолетовая линия
– фиолетовая линия
Массы mф и импульсы рф данных фотонов можно найти по формулам:
![]() (6) и
(6) и
![]() (7).
(7).
Схема некоторых переходов в атоме водорода приведена на рис. 1.
Напомним смысл обозначений в этой схеме. Наряду с главным квантовым числом n состояние электрона в атоме характеризуется орбитальным квантовым числом l и магнитным квантовым числом ml . Состояния электрона с l = 0,1,2 обозначаются как s -, p - и d - состояния соответственно. Но уровни энергии электрона в атоме (а значит, и длины волн излучения) не зависят от чисел l, ml, а определяются только главным квантовым числом n.
В квантовой механике доказывается, что возможны не любые переходы электронов в атоме, а лишь такие, при которых изменение орбитального квантового числа l соответствует правилу отбора
![]() . (8)
. (8)
В соответствии с правилом (8), в первых двух сериях в спектре атома водорода разрешены переходы (см. рис. 1):

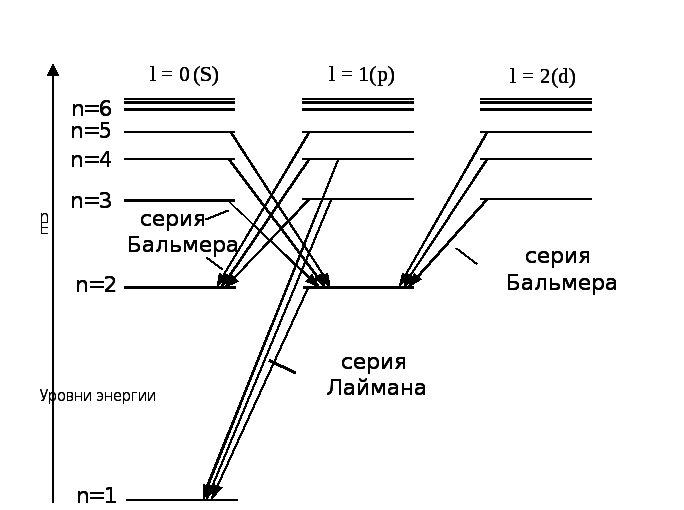
Рис. 1. Схема электронных переходов в атоме водорода
