
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Уральский государственный экономический университет
ОРГАНИЧЕСКАЯ ХИМИЯ
Учебное пособие
для студентов заочной формы обучения специальностей
260202 (технология хлеба, кондитерских и макаронных изделий),
260501 (технология продуктов общественного питания),
080401 (товароведение и экспертизатоваровпообластямприменения)
Екатеринбург
2007
1
Составители:
Калугина И.Ю., Аксенова Т.Ф., Макаренко И.М.
2
СОДЕРЖАНИЕ
Введение………………………………………………………………………………. 4
1.Номенклатура органических соединений………………………………….. 5
2.Углеводороды…………………………………………………………………… 8
2.1.Основные теоретические положения……………………………………... 8
2.2. Подведем итоги………………………………………………………………… |
13 |
2.3. Лабораторный практикум и индивидуальные задания………………… |
20 |
3.Спирты. Фенолы………………………………………………………………. 25
3.1.Основные теоретические положения……………………………………... 25
3.2.Подведем итоги………………………………………………………………… 29
3.3. Лабораторный практикум и индивидуальные задания………………… 32
4.Альдегиды. Кетоны…………………………………………………………… 36
4.1.Основные теоретические положения…………………………………….. 36
4.2.Подведем итоги………………………………………………………………… 40
4.3. |
Лабораторный практикум и индивидуальные задания………………… |
45 |
5. |
Карбоновые кислоты. Сложные эфиры. Жиры………………………… |
47 |
5.1.Основные теоретические положения……………………………………... 47
5.2.Подведем итоги………………………………………………………………… 51
5.3. Лабораторный практикум и индивидуальные задания………………… |
53 |
6. Углеводы………………………………………………………………………….. |
57 |
6.1.Основные теоретические положения……………………………………... 57
6.2.Подведем итоги………………………………………………………………… 66
6.3. |
Лабораторный практикум и индивидуальные задания………………… |
70 |
7. |
Амины…………………………………………………………………………….. |
74 |
7.1.Основные теоретические положения……………………………………... 74
7.2.Подведем итоги………………………………………………………………… 77
7.3. |
Лабораторный практикум и индивидуальные задания………………… |
78 |
8. |
Аминокислоты. Белки………………………………………………………… |
84 |
8.1.Основные теоретические положения……………………………………... 84
8.2.Подведем итоги………………………………………………………………… 90
8.3. Лабораторный практикум и индивидуальные задания………………… |
91 |
9. Литература……………………………………………………………………… |
97 |
3

ВВЕДЕНИЕ
Данное учебное пособие предназначено помочь студентам самостоятельно изучить основные разделы курса органическая химия, подготовиться к выполнению лабораторных работ и контрольных заданий.
В учебном пособии представлены следующие материалы: номенклатура органических соединений, основные теоретические положения по основным разделам курса, итоговые таблицы, включающие важнейшие химические свойства и способы получения основных классов органических соединений, методические указания для выполнения лабораторных работ, индивидуальные задания для самостоятельной работы студентов, список основной и дополнительной учебной литературы по органической химии.
Лабораторные работы являются важнейшей составной частью учебного процесса по органической химии. Они способствуют выработке знаний и умений, приобретению навыков экспериментальной работы.
Лабораторные работы объединены по классам органических соединений. Реакции выполняются в полумикрохимических пробирках или на предметных стеклах. При проведении опытов используются очень малые количества реактивов, а также капельные реакции на фильтровальной бумаге.
Для успешного овладения практической частью курса органическая химия студентам необходимо дома провести следующую подготовку к лабораторной работе:
1.прочитать внимательно в данном руководстве теоретические объяснения перед каждым классом органических соединений;
2.ознакомиться с методикой проведения опытов, понять их значение;
3.уяснить уравнения реакций, лежащих в основе опыта;
4.подготовить лабораторный отчет по прилагаемой схеме, заполнив колонки 1 (№ опыта), 2 (название опыта), 3 (формулы исходных веществ), 5 (уравнения реакций) дома и колонки 4 (наблюдения) и 6 (выводы) во время проведения лабораторного эксперимента.
Отчет по лабораторной работе оформляется в таблице, которая расчерчивается на развернутом листе тетради по следующей схеме:
на левой странице
№ опыта |
Название опыта |
Формулы исходных |
Наблюдения |
|
|
веществ |
|
1 |
2 |
3 |
4 |
4

на правой странице
Уравнения реакций |
Выводы |
5 |
6 |
Для проверки умений студентов применять полученные знания к решению конкретной задачи, в методических указаниях приводятся индивидуальные задания, которые будут выполняться каждым студентом самостоятельно на аудиторных занятиях.
1.НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Ворганической химии существует три вида номенклатуры: тривиальная, рациональная и международная (ИЮПАК).
Тривиальная номенклатура – это случайные названия органических соединений, отражающие их природный источник, способ получения, свойство, фамилию ученого и т.д. Например, муравьиная кислота, хлороформ, кетон Михлера.
Рациональная номенклатура учитывает строение называемого соединения. Названия образуются от первых членов гомологического ряда (метан, этилен, карбинол и т.д.), у которых атомы водорода замещаются на другие атомы и группы атомов:
H3C |
|
|
CH |
|
CH2 |
CH3 |
H3C |
|
CH2 |
CH |
|
OH |
|
|
|
|
|||||||||
|
|
|
|
|||||||||
|
|
|
CH3 |
|
|
|
CH3 |
|||||
диметилэтилметан |
метилэтилкарбинол |
|||||||||||
Номенклатура ИЮПАК строится следующим образом: выбирается наиболее длинная цепь атомов углерода и нумеруется, нумерация начинается с того конца, к которому ближе радикал-заместитель. При наличии нескольких заместителей сумма цифр, обозначающих положение их в цепи, должна быть наименьшей. В названии вещества указывается цифрой место заместителя, называется сам заместитель, а затем главная цепь по числу атомов углерода с добавлением суффикса, соответствующего тому или иному классу органических соединений. Если радикалы повторяются, то перечисляются цифры, указывающие их положение, а число одинаковых радикалов указывается приставками ди-, три-, тетра- и т.д:
5

7 |
6 |
5 |
4 |
3 |
|
|
|
||
H3C |
|
CH2 |
CH2 |
CH |
|
CH |
|
CH3 |
3,4-диметилгептан |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
CH3 CH2 CH3
2 1
При наличии кратной связи или функциональной группы главная цепь выбирается таким образом, чтобы в нее входила кратная связь или углеродный атом, содержащий функциональную группу. Нумерация цепи начинается с того конца, к которому ближе кратная связь или функциональная группа. Ее место указывается цифрой перед названием главной цепи:
|
5 |
|
|
4 |
|
|
|
|
3 |
|
|
|
|
2 |
|
1 |
|
|
|
|||||||
|
CH3 |
|
CH2 |
|
|
CH |
|
|
CH |
|
CH3 |
3-этил-2-пентанол |
|
|||||||||||||
|
|
|
|
|
||||||||||||||||||||||
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
CH2 |
OH |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Суффиксы важнейших классов органических соединений: |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Классы |
|
|
|
Характер |
|
|
|
Название связи или |
|
Суффикс в названии |
||||||||||||||||
органических |
связи,функциональн |
функциональной |
|
соединения |
||||||||||||||||||||||
соединений |
|
|
|
ая группа |
|
|
|
|
группы |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-ан |
|
Алканы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
одинарная связь |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Алкены |
|
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
|
|
двойная связь |
|
-ен |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Алкины |
|
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
|
|
тройная связь |
|
-ин |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Спирты |
|
|
|
|
|
|
|
|
|
OH |
|
|
|
гидроксигруппа |
|
-ол |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Альдегиды |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
альдегидная группа |
|
-аль |
|||||||
|
|
|
|
|
|
|
|
|
C |
H |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-он |
|
Кетоны |
|
|
|
|
|
|
|
C |
O |
|
|
|
карбонильная |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
группа |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Карбоновые |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
карбоксильная |
|
-овая кислота |
|||||||
кислоты |
|
|
|
|
|
|
|
C OH |
|
|
|
|
группа |
|
-оат |
|||||||||||
Сложные эфиры |
R |
|
C |
|
O |
|
|
|
|
|
|
|
сложноэфирная |
|
||||||||||||
|
|
|
|
O |
|
|
|
R |
1 |
|
|
|
группа |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-амин |
|||||||||||||||
Амины |
|
|
|
|
–NH2 |
|
|
|
амино группа |
|
||||||||||||||||
|
|
|
|
–SO3H |
|
|
|
сульфогруппа |
|
|
||||||||||||||||
|
|
|
|
|
–NO2 |
|
|
|
|
нитрогруппа |
|
|
||||||||||||||
6
|
–N=O |
нитрозогруппа |
|
–С ≡ N |
нитрильная или |
|
|
цианогруппа |
|
–N=N– |
азогруппа |
Формулы и названия некоторых радикалов
Формулы радикалов |
Названия радикалов |
|||||||||||||||||||||||||||||||
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метил |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
CH2 |
|
|
|
|
|
этил |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
CH2 |
CH2 |
|
|
н-пропил или первичный пропил |
||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
CH |
|
|
|
|
CH3 |
изопропил или вторичный пропил |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
CH2 |
|
CH2 |
CH2 |
|
первичный бутил |
||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH |
|
|
|
|
CH2 |
|
|
|
изобутил |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
CH3 |
|
|||||||||||||||||||||||
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
третичный бутил или необутил |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
C |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|||||||||||||||||||
H3C |
|
|
CH2 |
|
|
|
|
|
CH |
|
|
CH3 |
вторичный бутил |
|||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
CH |
|
|
|
|
|
|
|
винил |
||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенил |
бензил
CH2
Принципы названия циклических соединений те же самые, что и в алифатическом ряду. К наименованию главной цепи углеводорода добавляется приставка цикло-: циклопропан, циклогексан и т.д.
Углеводороды ароматического ряда называются как производные бензола, у которого атомы водорода замещены на другие атомы или группы атомов. Например, метилбензол, орто- диметилбензол.
7
2.УГЛЕВОДОРОДЫ
2.1ОСНОВЫНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
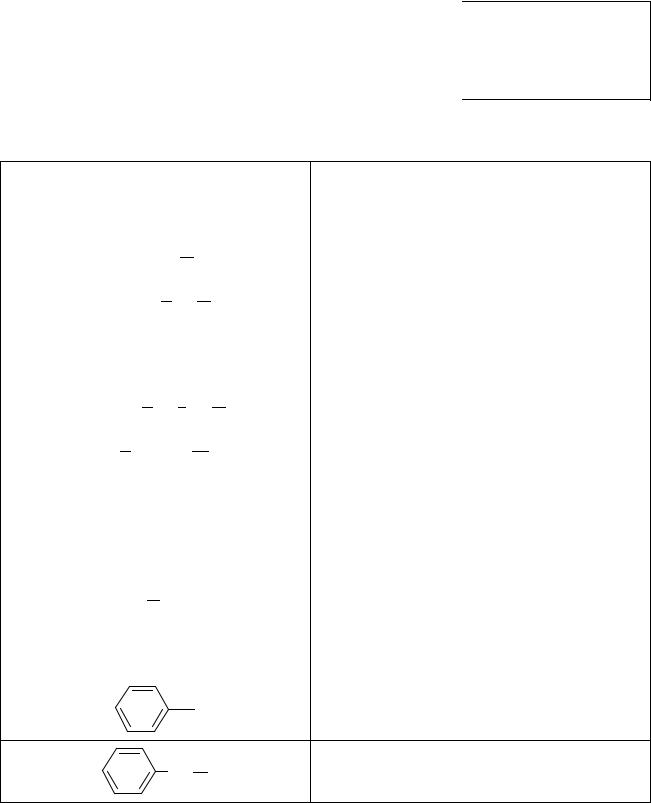
Углеводороды алифатического ряда RH отличаются друг от друга различным характером ковалентных связей в молекуле. Предельные углеводороды содержат только ординарные σ- связи, а непредельные углеводороды содержат кроме σ-связей, еще π-связи (двойные или тройные). Электронное строение σ- и π- связей различно, поэтому различна у них реакционная способность.
σ-Связь - ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов.
π-
Связь
образуется между атомами, уже соединенными σ-связью. Эта связь слабее σ- связи из-за менее полного перекрывания р-АО.
Характерные особенности σ- и π-связей
1. σ-Связь прочнее π-связи. Это обусловлено более эффективным перекрыванием атомных орбиталей при образовании σ-молекулярных орбиталей и нахождением σ-электронов между ядрами.
8
2. По σ-связям возможно внутримолекулярное вращение атомов, т.к.
форма σ- молекулярных орбиталей допускает такое вращение без разрыва связи. Вращение по π-связи невозможно без ее разрыва!
3.Электроны на π- молекулярных орбиталях, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Так как σ- связи прочные, для их разрыва требуются особые условия.
Предельные углеводороды вступают в реакции замещения атомов водорода при высоких температурах, УФ-облучении.
π-Связи реакционноспособные, легко разрываются, поэтому для
непредельных углеводородов характерны реакции присоединения с разрывом
π- связи при нормальных условиях или невысоких температурах, в присутствии катализаторов кислого характера (опыт 1).
При написании уравнений реакций, характеризующих химические свойства различных углеводородов, нужно помнить следующие правила:
1.в предельных углеводородах атом водорода наиболее активен у третичного атома углерода, затем - у вторичного, у первичного - имеет наименьшую активность;
2.в непредельных углеводородах реакция присоединения по кратной связи идет по правилу Марковникова - атом водорода из реагента присоединяется к наиболее гидрогенизированному атому углерода при двойной или тройной связи;
3.реакция отщепления молекулы галогеноводорода от галогенпроизводных углеводородов или воды от спиртов происходит по правилу Зайцева - атом водорода в углеводородной цепи отщепляется от
менее гидрогенизированного атома углерода, стоящего рядом с атомом углерода, содержащим функциональную группу.
9
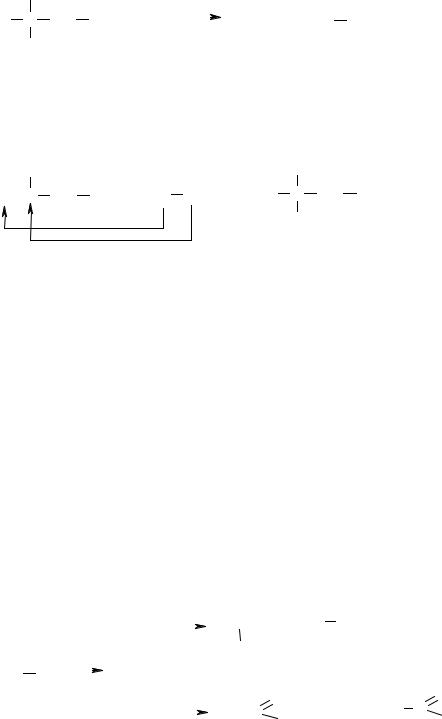
H
H3C C CH2 CH3 CH3
2-метилбутан
CH3
H2C C CH2 CH3
C CH2 CH3
+ Cl2 |
уф |
|
|
Cl |
+ HCl |
||||
H3C |
|
|
|
|
|
|
|||
|
|
C |
|
CH2 |
CH3 |
||||
|
|||||||||
|
|
|
|||||||
|
|
|
|
|
|||||
|
|
|
|
CH3 |
|
||||
|
|
2-метил-2-хлорбутан |
|
||||||
CH3
+ H Cl  H3C C CH2 CH3
H3C C CH2 CH3
Cl
2-метил-1-бутен 2-метил-2-хлорбутан
Реакции окисления в ряду предельных и непредельных углеводородов имеют свои отличительные особенности.
Предельные углеводороды окисляются в жестких условиях (высокие температуры, сильные окислители) с расщеплением цепи атомов углерода и образованием карбоновых кислот с меньшим числом атомов углерода в молекуле.
Непредельные углеводороды легко вступают в реакцию окисления:
а) в мягких условиях по месту разрыва π- связи образуются двухатомные спирты - гликоли;
б) в жестких условиях при повышенных температурах разрывается цепь атомов углерода по кратной связи, и образующиеся осколки молекул окисляются до конечных продуктов реакции - главным образом карбоновых кислот (опыт 2).
|
|
|
|
|
|
|
|
[O] |
|
H2C |
|
|
CH |
|
CH2 |
CH3 |
1,2-бутандиол |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
KMnO4 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
OH |
OH |
|
|
|
|
|
|
|||||||
H2C |
|
CH |
|
CH2 |
CH3 |
|
|
[O] |
|
|
|
C O |
+ |
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
1-бутен |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
H |
|
|
H3C |
|
CH2 |
C OH |
||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
K2Cr2O7 |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
пропионовая |
||||||
|
|
|
|
|
|
|
|
t0 |
|
муравьиная |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
кислота |
||||||||||||
|
|
|
|
|
|
|
|
|
кислота |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
В ряду углеводородов ацетиленового ряда, атомы водорода при углероде с тройной связью обладают слабо кислотным характером и способны замещаться на металл в реакции со специфическими реагентами:
аммиачным раствором оксида серебра [Ag(NH3)2]OH, аммиачным раствором хлорида меди [Cu(NH3)2]Cl, амидом натрия NaNH2 (опыт 3).
10
HC |
|
CH + 2 [Ag(NH3)2]OH |
|
|
Ag |
|
C |
|
C |
|
Ag + 4 NH3 + 2H2O |
|||
|
|
|||||||||||||
|
|
|
|
|||||||||||
|
|
|||||||||||||
|
|
|||||||||||||
|
|
|
|
|
ацетиленид серебра |
|
||||||||
Углеводороды |
ароматического |
ряда |
|
|
ArH имеют |
особенности в |
||||||||
электронном строении молекул. |
|
|
|
|
|
|
|
|
|
|||||
Бензол С6Н6 |
– родоначальник |
ароматических |
углеводородов. |
|||||||||||
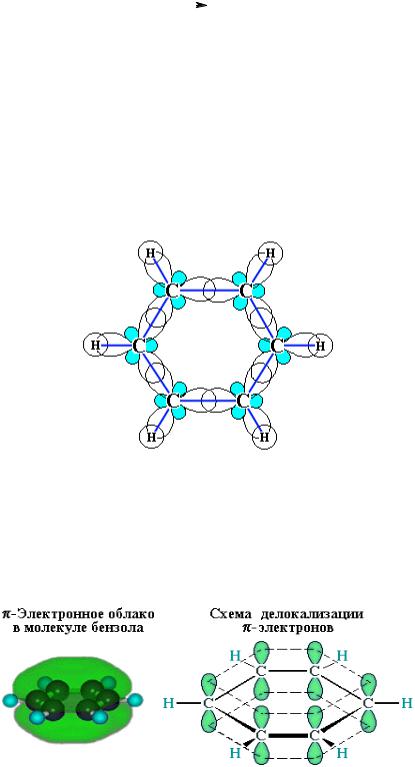
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2- гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой σ-связей равны 120°. Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С−С и С−Н лежат в одной плоскости:
р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости σ-скелета бензольного кольца. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Все связи С−С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены
(делокализованы). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) и кружка внутри него, обозначающего делокализованные π-связи:
11

Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость,
обусловленную делокализацией π-электронов в циклической системе, и специфические свойства.
Критерии ароматичности аренов
1.Атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему.
2.Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит 4n+2 π-электронов (n – целое число).
Этим критериям полностью соответствует молекула бензола С6Н6.
Следует обратить внимание на то, что арены относятся к ненасыщенным соединения, но за счет циклического строения и наличия эффекта сопряжения для них наиболее характерны реакции замещения атомов водорода при углеродных атомах в цикле и менее характерны реакции присоединения по π- связи в цикле.
В молекуле бензола в мягких условиях (невысокая температура, катализаторы кислого характера) идет реакция замещения любого атома водорода, так как реакционная способность в нем всех атомов углерода одинаковая.
+Cl2 |
Cl |
+HCl |
|
|
AlCl3 |
бензол |
хлорбензол |
|
Наличие заместителей в бензольном ядре влияет на ход реакции.
12
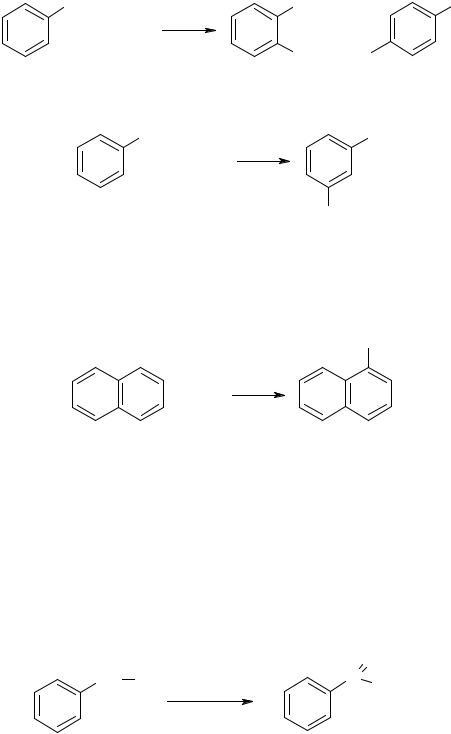
Заместители 1 рода – электронодонорные группы (–OH, –NH2, R–, галогены), облегчающие реакции замещения и направляющие новый заместитель по отношению к себе в орто- (рядом) и пара- (через два атома углерода) положение.
Заместители 2 рода – электроноакцепторные группы (–SO3H, –NO2, – СООН, =C=O), затрудняющие реакции и направляющие новый заместитель в мета - (через один атом углерода) положение.
CH3 |
FeCl3 |
CH3 |
|
CH3 |
2 |
+ 2Cl2 |
|
+ |
+ 2HCl |
толуол |
|
Cl |
|
Cl |
|
орто- |
|
пара- |
|
|
|
хлортолуол |
|
хлортолуол |
|
NO2 |
H2SO4 |
|
NO2 |
|
+ Cl2 |
|
+ HCl |
|
Cl
нитробензол мета-нитрохлорбензол
В молекуле нафталина в реакциях замещения α- положение наиболее активно (опыт 4).
Cl
FeCl3
+ Cl2 |
+ HCl |
нафталин α -хлорнафталин
Ароматические углеводороды имеют прочный цикл, поэтому реакции окисления по бензольному ядру идут в очень жестких условиях (высокие температуры, сильные окислители). Боковая цепь окисляется легче с образованием карбоновых кислот. Нужно помнить о том, что какой бы длины не была боковая цепь, окисляется атом углерода связанный с бензольным ядром, остальные атомы углерода и водорода окисляются до СО2 и Н2О (опыт 5).
CH |
CH |
|
|
|
C |
O |
|
|
+[O] |
|
OH + CO2 + H2O |
||||
2 |
3 |
|
|
|
|
||
KMnO4 |
t0 |
||||||
|
|
|
|||||
этилбензол |
|
|
|
|
бензойная кислота |
||
13
