
- •Определение жесткости воды
- •Термины и определения
- •1 Мл 0,1n hCl 2,004 мг Са
- •V 0,1nhClX мг Са
- •Меры предостороженности при проведении работ с химическими реактивами
- •Теоретическая часть
- •Методы устранения жесткости воды.
- •III. Экспериментальная часть
- •Опыт 2. Определение общей жесткости воды комплексонометрическим методом
- •Порядок выполнения работы:
- •Обработка результатов определения
- •Контрольные вопросы
- •Библиографический список
Определение жесткости воды
Цель работы - овладение методом количественного анализа воды по показателям постоянной и временной жесткости.
Термины и определения
ЖЕСТКОСТЬ ВОДЫ- это показатель природной воды, обусловленный наличием в ней растворенных солей кальция и магния. Измеряется жесткость в миллиграмм-эквивалентах в литре раствора (мг-экв/л) – приведенной величине, учитывающей весовую концентрацию каждого иона в мг/л, его молекулярный вес и электрический заряд. Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+или 12,16 миллиграмм Mg2+(атомная масса делённая на валентность).
Кальциевую и магниевую жесткости можно перевести в весовое содержание этих элементов в воде и наоборот в следующих соотношениях:
МСа= 20,04 ЖСа(мг/л); ЖСа= МСа/20,04 (мг-экв/л)
МMg= 12,16 ЖMg(мг/л); ЖMg= МMg/ 12,16 (мг-экв/л)
где М - весовое содержание кальция или магния в миллиграмах на 1 литр.
НОРМАЛЬНЫЙ РАСТВОРсодержит в 1 кубическом дециметре (литре) один г-экв растворенного вещества. Для наглядности сравнения нормальной и процентной концентраций рассмотрим подсчет процентности децинормального раствора соляной кислоты. ( 0,1N НCl ), который используется при титровании в данной работе.
Для подсчетов возьмем массовые числа Н(1,008) и Сl(35,45), сложим их (36,458), округлим (36), вычислим 0,1 (3,6). Значит, один литр 0,1N раствора HСl содержит 3,6 г кислоты, а в 100 г этого раствора - 0,36г HCl. Округленно процентность такого раствора - 0,4 %.
ТИТР -в объемном химическом анализе - концентрация раствора реактива, число граммов вещества в 1 мл раствора.
ТИТРОВАНИЕ - это метод объемного химического анализа, состоящий в постепенном струйно-капельном приливании реактива известной концентрации к известному объему другого реактива, концентрацию которого нужно установить в ходе опыта.
рН < 3 кислая среда - красный (розовый)
рН = 5,5 нормальная - оранжевый
рН > 7 щелочная - желтый (светло-желтый)
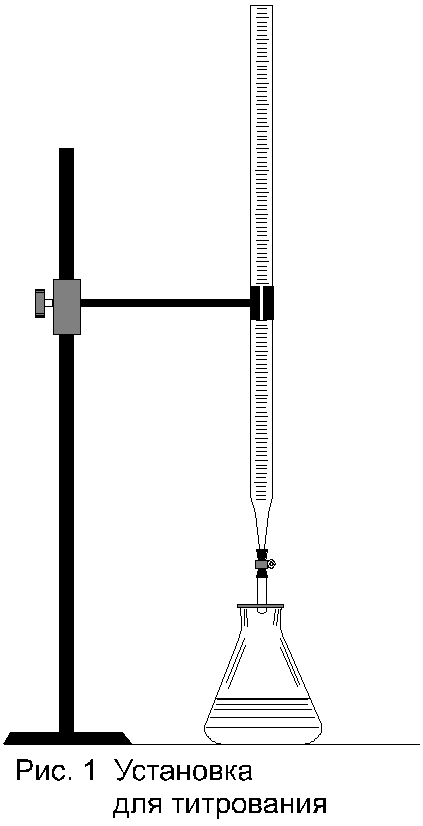
Титрование происходит в присутствии индикатора рН среды, по изменению цвета которого и прекращают титрование. Установка для титрования приведена на рисунке 1. Она состоит из металлического штатива, на котором закреплена стеклянная бюретка с кислотой и колбы с анализируемой жидкостью.
Существует пропорция для вычисления неизвестной концентрации примесей в анализируемой жидкости. Выведем ее из уравнения:
Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2 + 2H2O,
где известна нормальность (0,1) и количество кислоты, пошедшей на титрование. Количество анализируемой жидкости задано условием опыта, но может быть любое. Зная эквивалент Са (20,04), эквивалент соляной кислоты HCl(36,5) и считая, что 1 литр нормального раствора НСl прореагирует с 20,04 г Са2+, принимаем, что 1 мл 0,1N HCl соответствует 2,004 мг Са2+. Установив опытным путем объем кислоты V HCl, пошедший на титрование 50 мл жесткой воды, можно определить количество мг Са2+, содержащегося в этом объеме исследуемой воды, а затем и в литре такой воды, умножив полученную величину на 1000:50=20
