
Задача №4
Rp: Sol. Acidi hydrochloridi 3% - 100 ml
M.D.S. По 1 ст. л. 3 раза в день.
Количественный анализ провести методом алкалиметрии. Дать обоснование метода
Написать уравнения реакций
Сделать расчет допустимых норм отклонений
Рассчитать содержание кислоты хлористоводородной в лекарственной форме, учесть особенность в расчете титра
Сделать заключение о качестве препарата (лекарственной формы)
ОТВЕТ: На анализ поступила жидкая ЛФ для внутреннего применения – раствор кислоты хлористоводородной 3% - 100 мл, микстура. Согласно приказа МЗ РФ № 214 проводят следующие виды контроля.
Физический контроль. Бесцветная прозрачная летучая жидкость, своеобразного запаха, кислого вкуса, без механических примесей. Допустимая норма отклонений на 100 мл ± 3% = 3 мл; 97 мл ≤ х ≤ 103 мл
Вывод: объем ЛФ соответствует прописанному в рецепте.
Химический контроль. Проводятся реакции подлинности на катион Н+ и анион Сl-.
Н+:Присутствие ионов водорода определяют по изменению окраски индикатора (покраснение лакмусовой бумаги).
Сl-:
а)Р-ия осаждения с раствором серебра нитрата в азотнокислой среде.
HCl + AgNO3 = AgCl↓ + HNO3 (белый творожистый осадок; р-м в NH3)
AgCl + 2 NH4 ОН = [Ag(NH3)2]Cl + H2O
б)Р-ия на восст. св-ва ЛП
4HCl+MnO2=Cl2↑+MnCl2+2H2O (запах хлора)
Вывод: ЛФ соотв. своему наименованию.
Количественный анализ. Алкалиметрия, вар. нейтрализации. Основан на кислотных св-вах ЛП.
Титрант – раствор NaOH, индикатор – метиловый оранжевый
Методика: 2 мл ЛФ (пипеткой Мора)+2 мл воды очищенной (цилиндром)+2 кап. метилоранжа и титровать раствором натрия гидроксида (0,1 моль/л) до желтой окраски.
М. м. (HCl) = 36,5
HCl + NaOH = NaCl + H2O
f = 1
Расчет титра:
Т (НСl) =
 =
= = 0,04398 г/мл
= 0,04398 г/мл
1 мл 0,1н. раствора натрия гидроксида соответствует 0,04398 г 8,3%-ной НСl.
Расчет допустимых норм отклонений:
3,0 в 100 мл.
По рецепту выписано 100 мл микстуры.
Х = 3,0 (по рецепту)
3,0 ± 4% ± 0,12; 2,88 Х 3,12
Формула расчета:
X
( HCl)
= ,Vт=
,Vт= ;Vт=
3*2/0,04398*100 = 1,36 мл
;Vт=
3*2/0,04398*100 = 1,36 мл
Х(HCl) - масса определяемого лекарственного вещества, г;
V(NaOH) - объем титранта NaOH, мл;
k(NaOH) - коэффициент поправки титранта;
Т(HCl) - титр HCl по NaOH;
V1 - объем лекарственной формы, мл
а (лф) - навеска лекарственной формы, взятая для анализа, мл.
Задача №5
Rp: Solutionis Hydrogenii peroxydi 3% - 100 ml
D.S. 1 ст. ложку на стакан воды. Полоскание.
Количественный анализ провести методом перманганатометрии. Дать обоснование метода
Написать уравнения реакций
Рассчитать содержание пероксида водорода в лекарственной форме
ОТВЕТ: На анализ поступила ЖЛФ для наружного применения – раствор пероксида водорода 3%, полоскание. Согласно приказа МЗ РФ №214 провожу следующие виды контроля:
Физический контроль. Бесцветная, прозрачная жидкость без механических примесей. Норма отклонений на объем: 100мл ± 3% ± 3мл; 97мл ≤ х ≤103мл
Вывод: Объем ЛФ соответствует прописанному в рецепте.
Химический контроль.
Р-ия образования надхромовых кислот. К 0,5 мл лекарственной формы прибавить 5 капель разбавленной серной кислоты, 3 капли раствора дихромата калия, 0,5 мл эфира, встряхнуть. Образуются надхромовые кислоты, которые извлекаются в эфир. Эфирный слой окрашивается в синий цвет:
K2Cr2O7 + H2SO4 → H2Cr2O7+ K2SO4

Вывод: Лекарственная форма соответствует своему наименованию.
Количественное определение: Метод перманганатометрии. Метод основан на способности перекиси водорода окисляться перманганатом калия в кислой среде (на восст. св-вах ЛП).
5H2O2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5O2 + 8H2O
H2O2 – 2e = H2O + 2H+,
f = ½
Методика: 2 мл лекарственной формы (пипеткой Мора) поместить в мерную колбу на 100 мл, довести водой очищенной до метки. 5 мл полученного разведения поместить в колбу для титрования, прибавить 1 мл разбавленной серной кислоты. Титровать раствором калия перманганата (0,1 моль/л) УЧ (1/5KMnO4) до розовой окраски. М.м. (H2O2) = 34,01 г/моль
Т
(H2O2)
=

Т
(H2O2)
=
 =0,001701 г/мл
=0,001701 г/мл
1 мл 0,1 н. раствора перманганата калия соответствует 0,001701 г перекиси водорода, которой в препарате должно быть 2,7-3,3%.
Формула для расчета:
X(%)
=
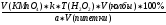 ,
,
где V(KMnO4) - объем титранта, мл;
k – поправочный коэффициент;
Т(H2O2) – титр пероксида водорода;
V(колбы) – объем мерной колбы, мл;
V(пипетки) –аликвота, взятая для разведения, мл.
а – навеска, взятая для титрования, мл;
