
ГОСы Все предметы / Ответы для 5 курса / Никотин-13
.docЗадача №13
Провести частичный фармакопейный анализ по указанным показателям субстанции кислота никотиновая
1) Идентифицировать препарат и обосновать реакции подлинности
Методика
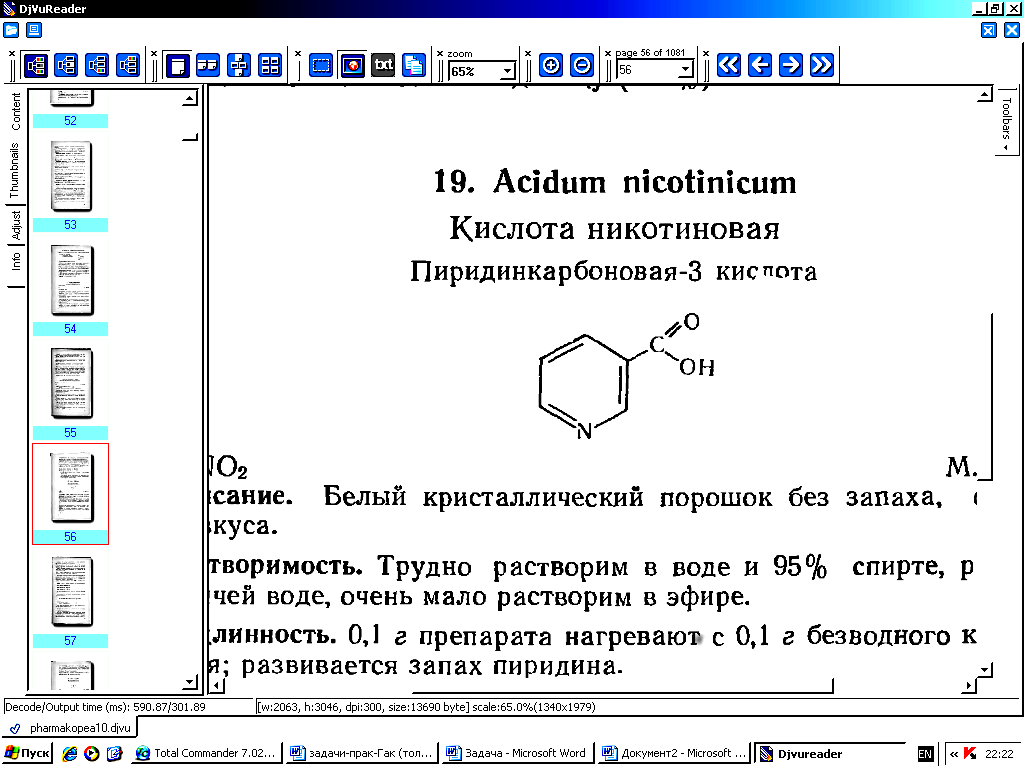
0,1 г препарата нагревают с 0,1 г безводного карбоната натрия. Развивается запах пиридина.
К 3 мл теплого раствора препарата (1:100) приливают 1 мл раствора сульфата меди. Выпадает осадок синего цвета.
К 10 мл такого же раствора прибавляют 0,5 мл раствора сульфата меди и 2 мл раствора роданида аммония. Появляется зеленое окрашивание.
2) Количественное определение кислоты никотиновой провести методом кислотно-основного титрования (вариант алкалиметрия). Сделать необходимые расчеты и заключение о соответствии субстанции требованиям ГФ Х.
Методика
Около 0,1 г (т.н.) растворяют в 20 мл свежепрокипяченной горячей воды и по охлаждении титруют раствором натрия гидроксида (0,1 моль/л) до неисчезающего в течение 1-2 минут розового окрашивания (индикатор - фенолфталеин).
М.м. (кислоты никотиновой) = 123,11.
Ответ
На анализ поступила субстанция кислоты никотиновой.

Acidum nicotinicum
Пиридинкарбоновая-3 кислота
Согласно приказа МЗ РФ №214 проводят следующие виды контроля:
1. Физический контроль.
Белый кристаллический порошок без запаха, слабо кислого вкуса. Трудно растворим в воде и 95% спирте, растворим в горячей воде, очень мало растворим в эфире.
2. Химический контроль.
a) 0,1 г препарата нагревают с 0,1 г безводного карбоната натрия. Происходит декарбоксилирование кислоты никотиновой. Развивается запах пиридина.
+
 Na2CO3
Na2CO3
 +
CO2
+
CO2
б) К 3 мл теплого раствора препарата (1:100) приливают 1 мл раствора сульфата меди. Выпадает осадок синего цвета.
2

 + CuSO4
+ CuSO4
 + H2SO4
+ H2SO4
в) К 10 мл такого же раствора прибавляют 0,5 мл раствора сульфата меди и 2 мл раствора роданида аммония. Появляется зеленое окрашивание.
2
 +
CuSO4
+ 2NH4SCN
+
CuSO4
+ 2NH4SCN
 + (NH4)
2SO4
+ (NH4)
2SO4
Количественный анализ.
Метод кислотно-основного титрования. Акалиметрия, вариант нейтрализации. Метод основан на реакции:

 +
NaOH
+
NaOH
 + H2O
+ H2O
Расчет титра:
Т (C6H5NO2)
=
![]() =
=
![]() = 0,01231 г/мл
= 0,01231 г/мл
1 мл 0,1н. раствора едкого натра соответствует 0,01231 г C6H5NO2, которой в препарате должно быть не менее 99,5% в пересчете на сухое вещество.
Формула расчета:
X
% (C6H5NO2)
=
![]()
X % (C6H5NO2) - содержание кислоты никотиновой, %
V(NaOH) - объем титранта, мл;
k(NaOH) - коэффициент поправки на титрованный раствор;
T(C6H5NO2) - титр никотиновой кислоты;
а - точная навеска препарата, взятая на титрование, г.
Содержание кислоты никотиновой в препарате должно быть не менее 99,5% в пересчете на сухое вещество. Если верхний предел не указан – 100,5%.
Заключение о качестве субстанции никотиновой кислоты, согласно требованиям ГФХ.
