
- •Оглавление
- •Тема 2.1. Развитие представлений о структуре материального мира 4
- •Тема 2.2. Свойства объектов микромира 26
- •Тема 2.3. Материя в пространстве и времени 46
- •Тема 2.4. Законы сохранения как проявление симметрии материального мира 59
- •Тема 2.5. Физические свойства объектов макромира. Хаос и самоорганизация 65
- •Тема 2.6. Химические процессы в макросистемах 91
- •Тема 2.7. Развитие представлений о строении и эволюции мегамира 112
- •Тема 2.1. Развитие представлений о структуре материального мира
- •Структурные уровни организации материи
- •Объекты микромира
- •Объекты макромира
- •Объекты мегамира
- •Корпускулярная и континуальная концепции описания природы
- •Взаимодействия и движение структур материального мира Четыре вида взаимодействий и их характеристика
- •Концепции близкодействия и дальнодействия
- •Характер движения структур мира
- •Энергия. Основные виды энергии
- •Тема 2.2. Свойства объектов микромира Развитие представлений о строении атомов
- •Теория атома н. Бора
- •Модель строения атома э. Резерфорда
- •Корпускулярно-волновой дуализм в современной физике
- •Элементарные частицы и их основные характеристики
- •Ядра атомов. Ядерная энергия
- •Основные положения теории суперобъединения (единой теории поля)
- •Методологические следствия из квантовой концепции
- •Тема 2.3. Материя в пространстве и времени Развитие представлений о пространстве и времени
- •Классическая концепция
- •Характеристики пространства, его трехмерность, однородность, изотропность. Характеристики времени, его анизотропность
- •Принцип относительности Галилея (принцип инерции). Инерциальные системы отсчета
- •Постулаты специальной теории относительности. Выводы из анализа преобразований Лоренца
- •Общая теория относительности: зависимость свойств пространства-времени от распределения материи
- •Тема 2.4. Законы сохранения как проявление симметрии материального мира Симметрия как инвариантность. Принципы симметрии
- •Симметрии пространства-времени
- •Связь законов сохранения с симметрией (теорема Нетер)
- •Закон сохранения импульса, закон сохранения момента импульса, закон сохранения заряда, закон сохранения энергии. Фундаментальный характер законов сохранения
- •Значение представлений о симметрии в познании объектов микро-, макро-, мегамира
- •Тема 2.5. Физические свойства объектов макромира. Хаос и самоорганизация Порядок и беспорядок в природе
- •Классическая термодинамика. Состояние. Параметры макросостояния: температура, давление, удельный объем
- •Закон сохранения энергии в макроскопических процессах (первое начало термодинамики)
- •Принцип возрастания энтропии (второе начало термодинамики) и необратимость времени
- •Направленность самопроизвольно протекающих процессов. Тепловая смерть Вселенной. Философский смысл возрастания энтропии
- •Молекулярно-кинетический (статистический) метод изучения макросистем. Вероятностный характер возрастания энтропии (Больцман)
- •Проблема возникновения упорядоченных структур в природе
- •Открытые системы. Неравновесные процессы. Синергетика (Хакен), неравновесная термодинамика (Пригожин)
- •Самоорганизация в живой и неживой природе, ее пороговый характер. Диссипативные структуры, флуктуация, бифуркация, аттрактор
- •Тема 2.6. Химические процессы в макросистемах Химия как наука
- •Основные химические концепции: учение о составе, структурная химия, химическая кинетика и термодинамика, эволюционная химия
- •Этапы развития химии
- •I. Донаучный этап
- •1. Натурфилософский период
- •2. Алхимический период
- •II. Научный этап
- •1. Становление учения о составе
- •2. Становление структурной химии
- •3. Изучение химических процессов
- •4. Эволюционная химия
- •Химический элемент. Вещество. Реакционная способность веществ
- •Химические процессы
- •Связь физических, химических и биологических форм движения материи
- •Тема 2.7. Развитие представлений о строении и эволюции мегамира Структура мегамира
- •Развитие представлений об организации мегамира. Модели Вселенной
- •Геоцентрическая система мира
- •Гелиоцентрическая система мира
- •Космологические теории классической механики
- •Модели устройства Вселенной, созданные на основе общей теории относительности и релятивистской теории тяготения
- •Стадии развития Вселенной
- •Структура современной Вселенной
- •Солнечная система
- •Внутреннее строение и история геологического развития Земли
Модель строения атома э. Резерфорда
В начале XXв. опытами по облучению тонкой фольги α-частицами Э. Резерфорд определил структуру атома. Он показал, что атом имеет планетарную модель (рис. 3), то есть состоит из плотного положительно заряженного ядра, вокруг которого обращается рыхлая электронная оболочка.
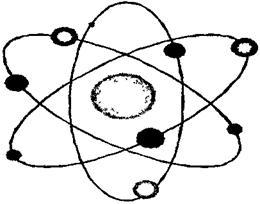
Рис. 3.Планетарная модель строения атома Э. Резерфорда
В целом атом является электронейтральной элементарной структурой химического элемента. Физический смысл порядкового номера Z-элемента в периодической системе элементов был установлен в планетарной модели атома Резерфорда. Z совпадает с числом положительных элементарных зарядов в ядре, закономерно возрастающих на единицу при переходе от предыдущего элемента к последующему. Химические свойства элементов и ряд их физических свойств объясняются поведением внешних, так называемых валентных электронов их атомов.
Поэтому периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах различных элементов. Теория периодической системы основывается на следующих положениях:
а) порядковый номер химического элемента равен общему числу электронов в атоме данного элемента;
б) состояние электронов в атоме определяется набором их квантовых чисел п, l, m и ms. Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
в) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
(Подробнее об этом можно прочитать в теме 2.6.)
Электроны в атоме, занимающие совокупность состояний с одинаковым значением главного квантового числа п, образуют электронную оболочку, или электронный слой. В зависимости от значенийnразличают следующие оболочки:К прип = 1,Lприп = 2,Мприn= 3,N прип = 4,Оприп = 5 и т. д. Максимальное число электронов, которые могут находиться в оболочках согласно принципу Паули: вК-оболочке – 2 электрона, в оболочкахL,М,N иОсоответственно 8, 18, 32 и 50 электронов. В каждой из оболочек электроны распределяются по подгруппам или подоболочкам, каждая из которых соответствует определенному значению орбитального квантового числа. В атомной физике принято обозначать электронное состояние в атоме символомпl, указывающим значение двух квантовых чисел. Электроны, находящиеся в состояниях, характеризуемых одинаковыми квантовыми числамиnиl, называются эквивалентными. ЧислоZ-эквивалентных электронов указывается показателем степени в символеnlz. Если электроны находятся в некоторых состояниях с определенными значениями квантовых чиселп иl, то считается заданной так называемая электронная конфигурация. Например, основное состояние атома кислорода можно выразить следующей символической формулой: 1s2, 2s2, 2p4. Она показывает, что два электрона находятся в состояниях сn= 1 иl= 0, два электрона имеют квантовые числаn= 2 иl= 0 и четыре электрона занимают состоянияc n = 2 иl= 1.
Порядок заполнения электронных состояний в оболочках атомов, а в пределах одной оболочки – в подгруппах (подоболочках) должен соответствовать последовательности расположения энергетических уровней с данными п иl. Сначала заполняются состояния с наименьшей возможной энергией, а затем состояния со все более высокой энергией. Для легких атомов этот порядок соответствует тому, что сначала заполняется оболочка с меньшимп и лишь затем должна заполняться электронами следующая оболочка. В пределах однойоболочки сначала заполняются состояния с l = 0, а затем состояния с большими l, вплоть доl=п – 1. Взаимодействие между электронами приводит к тому, что для достаточно больших главных квантовых чиселnсостояния с большимnи малымlмогут иметь меньшую энергию, то есть быть энергетически более выгодными, чем состояния с меньшимп, но с большимl. Из изложенного следует, что периодичность химических свойств элементов объясняется повторяемостью электронных конфигураций во внешних электронных подгруппах у атомов родственных элементов.
