
fizika_1_31_23
.docx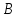 условиях
невесомости или при свободном падении
жидкость принимает форму шара, пытаясь
т.о.
сделать свою поверхность как можно
меньше,а у тел равного объёма,но разной
формы наименьшая площадь поверхности
у шара.И в таком состояния свободная
энергия поверхностного слоя минимальна.
условиях
невесомости или при свободном падении
жидкость принимает форму шара, пытаясь
т.о.
сделать свою поверхность как можно
меньше,а у тел равного объёма,но разной
формы наименьшая площадь поверхности
у шара.И в таком состояния свободная
энергия поверхностного слоя минимальна.
№13.Сила поверхностного натяжения. КПН. Свободная энергия поверхности жидкости.
Поверхностным
натяжением наз. напряжённое механическое
состояние поверхностного слоя жидкости
толщиной в несколько молекулярных
радиусов. зависит от молекулярной структуры
жидкости и температуры.
зависит от молекулярной структуры
жидкости и температуры.
 повехностного натяжения сообщают
молекулам поверхности потенциальную
энергию их взаимодействия и эта энергия
наз. свободной энергией поверхностного
слоя W=
повехностного натяжения сообщают
молекулам поверхности потенциальную
энергию их взаимодействия и эта энергия
наз. свободной энергией поверхностного
слоя W= S
S
 площадь
поверхности жидкости
площадь
поверхности жидкости
 условиях
невесомости или при свободном падении
жидкость принимает форму шара, пытаясь
т.о.
сделать свою поверхность как можно
меньше,а у тел равного объёма,но разной
формы наименьшая площадь поверхности
у шара.И в таком состояния свободная
энергия поверхностного слоя
минимальна.
условиях
невесомости или при свободном падении
жидкость принимает форму шара, пытаясь
т.о.
сделать свою поверхность как можно
меньше,а у тел равного объёма,но разной
формы наименьшая площадь поверхности
у шара.И в таком состояния свободная
энергия поверхностного слоя
минимальна. хностное
натяжение можно уменьшать не только
повышением температур,но и давлением
др.
жидкости,кот. растекается поп поверхности
воды. Такие в-ва наз. поверхностно-активными.
Это различные нефтепродукты,мыльные
р-ры и т.д.
хностное
натяжение можно уменьшать не только
повышением температур,но и давлением
др.
жидкости,кот. растекается поп поверхности
воды. Такие в-ва наз. поверхностно-активными.
Это различные нефтепродукты,мыльные
р-ры и т.д.
№14.Явления смачивания и несмачивания. Полное смачивание (несмачивание). Краевой угол.
Смачивание жидкости какой-либо поверности приводит к тому,что жидкость по ней растекается.(рис.)Не смачиванием наз. явление,когда жидкость образует на тв. поверхности крупные капли.Явление смачивания объясн. Тем,что молекулы внутри жидкости м/у собой взаимодействуют слабее,чем с атомами или молекулами поверхности,а не смачивание,что молекулы жидкости м/у собой взаимодействуют сильнее,чем с атомами или молекулами поверхности.Величина смачивания или не смачивания хар-ся краевым углом.Краевой угол-угол м/у поверхностью и касательной к жидкости.При смачивании этот угол острый,и чем он меньше,тем больше смачивание.При не смачивании этот угол тупой.
№15.Мениск. Капилляр. Давление Лапласа для произвольной и сферической поверхностей.
(рис.) 7а-смачивание, 7в- не смачивание
Мениском наз. искривленная поверхность жидкости за счёт явления смачивания и не смачивания.Образование мениска приводит к явлениям наз. капиллярными.Благодаря этим явлениям жидкость либо поднимается в капилляре выше своего уровня в окруж. Среде, либо наоборот опускается в капилляре ниже своего уровня в окружающей среде. (рис).
Возникновение
такой силы приводит к появлению доп.
Давления наз. давлением Лапласа. Именно
это доп. Давление заставляет двигаться
воду в капиллярах. Доп. Давление определ.
По формуле: ∆P= (1/R₁+1/R₂)
(1/R₁+1/R₂)
 -КПН;
R₁
и R₂
- радиусы поверхности
-КПН;
R₁
и R₂
- радиусы поверхности
Если
R₁
=R₂
∆P= /R
/R
№16.Капиллярные
явления. Формула Жюрена. Капиллярные
явления в природе и технике. Явления
изменения высоты уровня жидкости в
капиллярах по сравнению с уровнем
жидкости в широких сосудах наз-ся
капиллярными явл-ми. Высота подъёма
жидкости в капилляре определ. по ф-ле
Жюрена h= cos
cos /ρgR;
/ρgR;
 -КПН;
-краевой угол(тетта);ρ-плотность;
g-ускорение
свободного падения; R-радиус
капилляра; hmax=2
-КПН;
-краевой угол(тетта);ρ-плотность;
g-ускорение
свободного падения; R-радиус
капилляра; hmax=2 /
ρgR
/
ρgR
 =00
-полное
смачивание; hmin=
-2
=00
-полное
смачивание; hmin=
-2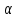 /
ρgR
/
ρgR
 =1800
-полное не смачивание. Почвенная
влага образует на частичках почвы
тонкую плёнку воды, св-ва кот. резко
отличаются от свободной воды.У этой
жидкости малый объём и большая поверхность
раздела.Такая влага наз. связанной и
силы поверх. Натяжения намного превосходят
всасывающую силу корневой системы
растений. Кол-во связанной воды зависит
от типов и структуры почвы.Меньше всего
связанной влаги в песчаных почвах(не
более 1,5%),в глинистых почвах от 12,до
20%,а в торфяниках 40-60%.
=1800
-полное не смачивание. Почвенная
влага образует на частичках почвы
тонкую плёнку воды, св-ва кот. резко
отличаются от свободной воды.У этой
жидкости малый объём и большая поверхность
раздела.Такая влага наз. связанной и
силы поверх. Натяжения намного превосходят
всасывающую силу корневой системы
растений. Кол-во связанной воды зависит
от типов и структуры почвы.Меньше всего
связанной влаги в песчаных почвах(не
более 1,5%),в глинистых почвах от 12,до
20%,а в торфяниках 40-60%.
С
энергитической точки зрения КПН равен
отношению свободной энергии поверхности
жидкости к площади этой поверхности
 =W/S
=W/S
№17.Кристаллические и аморфные тела и их свойства. Кристалл. Монокристаллы и поликристаллы.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические. Аморфные тела – тв. тела, св-ва кот. одинаковы по всем направлениям.По своей структуре аморфные тела очень близки к жидкостям.(стекло, различные затвердевшие смолы (янтарь), пластики и т. Д).Отличительной особенностью явл. Анизотропия – зависимость физич. Свойств в-ва от направления. Кристаллическими наз. тв. тела,имеющие упорядоченное,периодически повтояющееся распределение частиц(атомов, молекул,ионов).Кристалл- образование естественно правильной геометр. Формы.В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллы-совокупность беспорядочно сросшихся мелких кристаллов. Монокристаллы- тв. тела, частицы кот. образуют единую кристаллич. Решётку.Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
№18. Кристаллографический принцип классификации твёрдых тел. Элементарная ячейка, её параметры и формы.
Для
классификации кристаллов использ. 2
принципа:кристаллографич. И физический.
Кристаллографич. Принцип заключ. В
рассмотрении пространственной структуры
кристаллов без учёта особенностей
отдельных частиц.Геометрически весь
кристалл может быть получен путём
многократного повторения в 3-х различных
направлениях одного структурного
элемента,наз. элементарной ячейкой.
Элементарная ячейка-параллелепипед,
построенный на 3-х векторах a,b,c,направленных
вдоль рёбер,и углах м/у гранями
 -
параметры элементар. Ячейки.Длины рёбер
a,b,c
– периодами идентичности.Кристаллы
могут иметь от 4-х до нескольких сотен
граней. Св-ва кристаллов: какими бы не
были размеры,форма и число граней одного
и того же кристалла все плоские грани
пересекаются под определ. Углом.
-
параметры элементар. Ячейки.Длины рёбер
a,b,c
– периодами идентичности.Кристаллы
могут иметь от 4-х до нескольких сотен
граней. Св-ва кристаллов: какими бы не
были размеры,форма и число граней одного
и того же кристалла все плоские грани
пересекаются под определ. Углом.
№19. Физический принцип классификации твёрдых тел. Ионная, атомная, молекулярная и металлическая решётки.
С физич. Точки зрения различ. 4 типа кристаллич. Решётки:Ионная, атомная, молекулярная и металлическая.В узлах ионной кристалич. Решётки располаг. Почерёдно ионы противоположных знаков, взаимодействующие м/у собой с помощью кулоновских(электрич.) сил. Атомная кристаллич. Структура хар-ся наличием в узлах решётки нейтральных атомов,м/у кот. имеется ковалентная связь(обусловленная взаимным обменом валентными электронами м/у атомами:алмаз). Молекулярная структура в узлах решётки содерж. Нейтральные молекулы в-ва.(силы взаимодействия м/у ними обусловлены незначит. Смещением электронов в электронных оболочках атомов:лёд,нафталин).В узлах металлич. Решётки металла находятся положит. Ионы.М/у ними хаотично движутся электроны.Электроны отдел. От связи со своими атомами при образовании металлаи играют роль «цемента»,удерж. Вместе положит. Ионы кристалла. Или сами электроны удерж. В кристалле,благодаря притяжению со стороны ионов металлич. Решётки.
№20.Анализ диаграммы состояния вещества.Тройная и критичекая точки.
Диаграмма состояния представляет собой множество точек,соотв. равновесным состояниям различных фаз в-ва.Фазой наз. совокупность частей термодинамич. Системы с одинаковыми физич. Св-ми(лёд и вода).Графическую фазу в-ва изображ. С помощью диаграммы сотояния (рис.)Поэтому диаграммы остояния представл. собой совокупность 3-х линий – кривых плавления,парообразования и сублимации.При давлении меньше Ртр твёрдая фаза переходит в газообразную,минуя жидкую фазу.Так при норм. Окись СО₂(сухой лёд) превращается в газ (рис.)
Критической явл. Точка соотв. температуре Тдр. 1, выше кот. сущесвование жидкой фазы невозможно.При нагревании в-ва до критической температуры исчезает всякое различие м/у жидкостью и паром,т.е. жидкость преходит в газообразную фазу.
№21.Плавление и кристаллизация.Теплота плавления.Изменение объёма при плавлении.
Процессы
при кот. измен. Агрегатное состояние
наз. фазовыми переходами.Переход в-ва
из тв. фазы в жидкую наз. плавлением, а
обратный переход кристаллизацией.
(рис.)Кол-во теплоты,необходимое для
плавления тв. тела пропорционально
кол-ву образовавшейся жидкости
О=ƛ =ƛ(m₂-m₁)
m₂
и m₁
- массы жидкости до и послепроцесса;
ƛ-удельная теплота плавления,явл. Мерой
энергетических затрат,необход. Для
плавления тв. фазы в-ваЭто величина
численно равная кол-ву теплоты,необход.
Для плавления 1кг в-ва – физич.
Смысл.Большинство веществ при плавлении
расширяется, а при кристаллизации
сжимается.Исключение сост. Лёд,чугун,висмут
и сурьма.При плавлении расстояние м/у
ближайшими молеклами увелич.,а пустоты
заполн. Молекулами.Поэтому вода
оказывается плотнее льда.
=ƛ(m₂-m₁)
m₂
и m₁
- массы жидкости до и послепроцесса;
ƛ-удельная теплота плавления,явл. Мерой
энергетических затрат,необход. Для
плавления тв. фазы в-ваЭто величина
численно равная кол-ву теплоты,необход.
Для плавления 1кг в-ва – физич.
Смысл.Большинство веществ при плавлении
расширяется, а при кристаллизации
сжимается.Исключение сост. Лёд,чугун,висмут
и сурьма.При плавлении расстояние м/у
ближайшими молеклами увелич.,а пустоты
заполн. Молекулами.Поэтому вода
оказывается плотнее льда.
№22.Парообразование и конденсация.Сублимация.Кипение.
Переход
в-ва из жидкого состояния в газообразное
наз. паробразованием,а обратный преход
конденсацией.Переход жидкой фазы в
газообразную происходит 2-мя
путями-посредством испарения и
кипения.Испарением наз.
апарообразование,происход. Со свободной
поверхности жидкости. Парообразование,
происходящее со свободной поверхности
тв. тела наз. сублимацией.Если пространство
над поверхностью жидкости ограничено,то
интенсивность испарения и конденсации
выравниваются – наступает динамическое
равновесие. Теплота парообразования
определ. По формуле О=r =r(m₂-m₁)
m₂
и m₁
- массы пара до и после процесса;
r-удельная
теплота парообразования
=r(m₂-m₁)
m₂
и m₁
- массы пара до и после процесса;
r-удельная
теплота парообразования
Физич.
Смысл – О необходимо для испарения 1кг
в-ва.Теплота сублимации определ.
О=S =S(m₂-m₁)
S=ƛ+R-удельная
теплота сублимации
=S(m₂-m₁)
S=ƛ+R-удельная
теплота сублимации
Если упругость насыщенного пара станет равной внешнему давлению,испарение будет происходить не только с поверхности жидкости,но и во всём её объёме.Внутри жидкости начинают возникать пузырьки пара,всплывающие на поверхность и разрывающиеся над ней.Этот интенсивный процесс наз. кипением. Соотв. ему температура наз. температурой кипения.
№23.Влажность воздуха.Относительная влажность.Точка росы.
Влажность воздуха описывается следующими осн. Хар-ми.Абсолютная влажность-масса водяного пра,отнесённая к объёму воздуха,в кот. она содержится. [г/смᶟ]Максимальная влажность-масса водяного пра,кот. соотв. бы насыщению при данной температуре,отнесённая к объёму воздуха,в кот. она содержится.Максимальная влажность Е зависит только от температуры.Относительная влажность-выраженное в % отношение абсолютной влажности к максимальной f=a/E*100%
Точка росы-температура,при кот. пар,находящийся в воздухе,становится насыщенным. Точка росы хар-т начало конденсации водяного пара.
№24.Виды термодинамических систем. Внутренняя энергия газа с учётом числа степеней свободы молекул.
Термодинамич. Системой наз. совокупность большого числа матер-ых тел,кот. могут обмениваться вещ-ом и энергией как внутри системы,так и с внешней средой.(газ,заключённый в цилиндре под поршнем)Изолированной системой наз. система,кот. не может обмениваться с окруж. Средой ни вещ-ом,ни энергией.Замкнутой системой или закрытой наз. система,кот. обменивается с окруж. Средой только энергией.
Открытой системой наз. система,обменивающаяся с окруж. Средой и вещ-м и энергией.Для описания параметров таких систем использ. Специфические характеристики,наз. термодинамическими или параметрами состояния.(абсолютная температура, давление, объём,энтропия,внутр. Энергия). Стационарным наз. состояние системы с неизменными термодинамич. Параметрами.;наз. равновесным,если оно не обусловлено воздействием на систему внешних сил.Энергетической хар-ой термодинамич. Системы явл. Внутренняя энергия. Для идеального газа внутр. Энергия равна сумме кинетич. Энергии всех его молекул.Потенциальная энергия их взаимодействия счит.=0.Энергия поступательного движения одной молекулы идеального газа согласно теории Больцмана определ. Только числом атомов в молекуле и термодинамич. Температурой данной системы Wф=i*1/2KT W-средняя энергия поступат.движения; К-физ. Постоянная,наз. постоянной Больцмана; i-хар-ка молекулы,кот. определ. Число атомов в ней,число степеней свободы молекулы.Согласно теории Больцмана каждая степень свободы молекулы энергетически одинакова, это значит,что что на каждую из них приходится одно и тоже кол-во энергии. W0=1/2KT (одноатомные Wср₁=3/2KT; двухатомные Wср₂=5/2KT; многоатомные Wср₃=6/2KT=3KT
Внутр. Энергия – U=WсрN N-число молекул газа ; Wср=i/2 KT N=m/µ*Na
U= i/2 KT* m/µ*Na U= i/2* m/µRT R=KNa-молярная газовая постоянная Т-абсолют.t
U₁= i/2* m/µRT ₁ U₂= i/2* m/µRT₂ ∆U=U₂- U₁= i/2* m/µRT₂ - i/2* m/µRT ₁ = i/2* m/µR∆T
№25.Работа газа при расширении. Теплота. Удельная и молярная теплоёмкости. Уравнение Майера.
Теплотой наз. кол-во энергии,поглощаемая системой при её нагревании или выделяемая системой при её охлаждении. Q=с*m∆T m-масса газа; ∆T -изменение t;с*-удельная теплоёмкость газа Q=сm/µ∆T c-молярная теплоёмкость; m/µ-кол-во молей
Удельной теплоёмкостью наз. кол-во теплоты необходимой для нагревания единицы массы газа при нагревании на 1градусе цельсия.Молярной теплоёмкостью наз. кол-во теплоты,необходимой для нагревания 1моль газа
Физич. Смысл Q=1,Q=с
Газ можно нагревать 2-мя способами:
1)не давая ему расширяться,т.е. в сосуде с жёсткими стенками.При этом вся подводимая теплота уходит на увеличение внутр. Энергии газа.Такой способ нагревания газа наз. нагреванием при постоянном объёме.И тогда его теплоёмкость определ. По формуле
Сv=i/2R Cv*=i/2*R/µ
2)В сосуде с мягкими стенками.При этом часть теплоты идёт на нагревание газа,а др. часть теплоты на работу,кот. совершает газ при расширении.И тогда этот способ нагревания наз. нагреванием при постоянном давлении.И теплоёмкость газа определ. По формуле
Ср=i+2/2*R Cp*=i+2/2 R/µ
Майером было установлено соотношением/у теплоёмкостями газов.Это соотнош. Наз. урав-ем Майера Ср=Сv+R R=Cp-Cv=A
Молярной газовой постоянной наз. работа,совершаемая 1моль идеального газа при изменении его температуры на 1 К при постоянном давлении R[Дж/к*моль]
№26.Первое начало термодинамики и его применение к изопроцессам и адиабатному процессу.
Если газ нагревать,то он будет расширяться и двигать поршень.Будем считать,что трение отсутсвует.Тогда работа,соверш. Газом при изменении его объёма легко определ. По формуле (рис.) А=F∆L=PS∆L=P∆V S∆L=V
Для
любого изобарного процесса
А= =P
=P =P(V₂-V₁)=p∆V
R=Aµ
a=m/µR∆T
=P(V₂-V₁)=p∆V
R=Aµ
a=m/µR∆T
Для изохорного процесса V не меняется.
Для
изотермического процесса А= =
m/µRT
=
m/µRT =
m/µRT
Ln
V₂/V₁
PV=
m/µRT
=
m/µRT
Ln
V₂/V₁
PV=
m/µRT
P= m/µ*RT/V
Для адеабатического процесса: а)нагревать или охлаждать газ,б)проводить очень быстро.При этом процессе А совершается за счёт изменения внутр. Энергии системы А=-∆U=-i/2*m/µ *R∆T
Термодинамика-наука,кот. возникла в процессе создания тепловых двигателей.Тепловым двигателем 1-го рода наз. двигатель,работающий согласно закону Q=∆U+A
Вечным двигателем 1-го рода счит. Двигатель,кот. должен совершать А большую,чем получаемая тепловая энергия. Любой двигатель,соверш. Циклич. Процессы,т.е. проходя ч/з ряд термодинамич. Состояний возвращается в некот. Первоначальное положение ∆U=0 Amax=Q
№27.Энтропия. Второе начало термодинамики. Энтропия термодинамических процессов.
Самопроизвольно протекающие в природе процессы имеют одностороннюю напрвленность (камень,сжатый газ легко выходит из сосуда,но обратно в него не возвращается).Насколько вероятно то ли иное направление протекания процессов определ. 2-е начало термодинамики.
Вероятной хар-й состояния системы явл. Энтропия. Со статистич. Точки зрения энтропия – мера неупорядоченности системы.Под упорядоченностью системы понимают возможность указания местоположения молекул.Связь м/у степенью хаотичности системы и вероятностью соотв. её состояния была установлена Больцманом S=KLnW S-энтропия; К-постоянная Больцмана; W=N/N0-вероятность состояния системы;N-число комбинаций из элементов,составл. Систему,осущ. Данное её состояние;N0-число возможных состояний системы
Число
возможных состояний в 1-м случае =4,а во
2-м =8.В числителях дробей указано кол-во
комбинаций,осущ. Данное состояние.Согласно
2-му началу термодинамики в изолир.
Системе возможны лишь процессы,при
кот. энтропия не убывает ∆S≥0-неравенство
Клаузиуса.В общем случае энтропия
термодинамич. Систем при переходе из
состояния А в состояние В определ. По
формуле ∆S=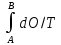 dO-приращение
теплоты О₂-О₁;Т-температура
теплоносителя; А и В-нач. и конеч.
Состояния системы
dO-приращение
теплоты О₂-О₁;Т-температура
теплоносителя; А и В-нач. и конеч.
Состояния системы
1.При
нагревании (Т₂>Т₁):
dO=сmdT,поэтому
∆S= =cm
=cm =cmLnT₂/T₁.Из
получ. Формулы следует,что при нагревании
системы её энтропия увелич.,а рпи
охлаждении уменьш.
=cmLnT₂/T₁.Из
получ. Формулы следует,что при нагревании
системы её энтропия увелич.,а рпи
охлаждении уменьш.
2.При плавлении dO=ƛdm,где ƛ-удельная теплота плавления, dm-масса образовавшейся жидкости
∆S= =
= =(r∆m)/T
т.е. при плавлении энтропия тела
возрастает,а при кристаллизации убывает
=(r∆m)/T
т.е. при плавлении энтропия тела
возрастает,а при кристаллизации убывает
3.При испарении dO=rdm,где r-удельная теплота парообразования,dm-масса пара
∆S= =
= =(r∆m)/T
т.е. при парообразовании(испарении)
энтропия системы увелич.,а при конденсации
уменьшается.
=(r∆m)/T
т.е. при парообразовании(испарении)
энтропия системы увелич.,а при конденсации
уменьшается.
32.
Фазовая скорость – велич., числ. равное
расстоян., к-ое проход. Волнов. Фронт в
един. Врем. ʋ= .
Длина волны – расстоян., пройден. Волной
за время равн. Периоду. ʎ=
.
Длина волны – расстоян., пройден. Волной
за время равн. Периоду. ʎ= .
Скорость продольн. И попер. Волн зависит
от объемной упругости и плотн. Среды:
ʋ=
.
Скорость продольн. И попер. Волн зависит
от объемной упругости и плотн. Среды:
ʋ= (прод. Волна), E – модуль Юнга, p – плотность
в-ва. ʋ=
(прод. Волна), E – модуль Юнга, p – плотность
в-ва. ʋ= (поперечн. Волны), G – модуль сдвига у
Тердого тела. Скорость в прод. Волн в
жид. Средах: ʋ=
(поперечн. Волны), G – модуль сдвига у
Тердого тела. Скорость в прод. Волн в
жид. Средах: ʋ= ,
K – модуль всестар. Сжатия, плотность
среды. Скорость распростр. Упругих волн
в газах зав. От t их природы. ʋ=
,
K – модуль всестар. Сжатия, плотность
среды. Скорость распростр. Упругих волн
в газах зав. От t их природы. ʋ= ,
где ɣ - постоян. Адиобата, µ - молярная
масса, R – универ. Газов. Постоянная. Из
определ. Длины волны следует, что
ʎ=ϑ*T=
,
где ɣ - постоян. Адиобата, µ - молярная
масса, R – универ. Газов. Постоянная. Из
определ. Длины волны следует, что
ʎ=ϑ*T= ,
откуда ϑ=ʎ*ʋ. Циклич. Частата выраж.
Слуд. Образ. W=2
,
откуда ϑ=ʎ*ʋ. Циклич. Частата выраж.
Слуд. Образ. W=2 .
Разделив w на ʋ, получим
.
Разделив w на ʋ, получим
 =
= =K.
Велич. K=
=K.
Велич. K= назыв. Волновым числом повторяет кол.
Проц. В пространстве.
назыв. Волновым числом повторяет кол.
Проц. В пространстве.
38.
Вязкое
трение возникает при движении твёрдых
тел в жидкой или газообразной среде,
или когда сама жидкость или газ текут
мимо неподвижных твёрдых тел. Причина
возникновения вязкого трения - это
внутреннее трение. Если твёрдое тело
движется в неподвижной среде, прилипший
к нему слой воды или воздуха перемещается
вместе с ним. При этом он скользит вдоль
соседнего слоя. Возникает сила трения,
увлекающая этот слой. Он приходит в
движение и в свою очередь увлекает
следующий слой и т. д. Чем дальше от
поверхности тела, тем медленнее движутся
слои жидкости или газа. Сила трения
между слоями тормозит более быстрые
слои и, значит, само твёрдое тело. Оно
тормозится непосредственно вязким
трением. То же самое происходит, когда
поток жидкости или газа течёт мимо
неподвижного тела. Налейте в тарелку
немного воды и опустите туда щепку.
Подуйте на щепку – она поплывёт по
воде. И даже если вы подули слабо, щепка
всё равно сдвинется с места. Главное
отличие вязкого трения от сухого состоит
в том, что не существует вязкого трения
покоя! Сопротивление трения- обусловлено
слоями внутреннего трения, которое
зависит от формы и размеров твердого
тела, также от вязких свойств жидкости.
Сопротивление давления- определяется
разностью давлений на передней и задней
стенках обтекаемого тела. Разность
давлений обусловлена возникновением
вихрей ( круговых движений частиц)
позади движущегося тела. В результате
v частиц сверху тела, больше чем в низу,
а значит по правилу Бернулли
 .
По этому в поперечном направлении
возникает подъёмная сила F. Это явления
получило названия «эффект Магнусса.
Подъёмная сила крыла- разность скоростей
потоков сверху и снизу крыла, обусловливает
возникновения вертикальной силы,
направленной в верх (подъёмной силы
F).
.
По этому в поперечном направлении
возникает подъёмная сила F. Это явления
получило названия «эффект Магнусса.
Подъёмная сила крыла- разность скоростей
потоков сверху и снизу крыла, обусловливает
возникновения вертикальной силы,
направленной в верх (подъёмной силы
F).
36.
Следствием
закона сохранения энергии для
стационарного течения идеальной
жидкости является ур-ние Бернули.
Выразим силы давления на жидкость в
сечениях S1
и S2.
F1=p1S1;F2=p2S2;
 =
= ;
;
 ; p=
; p=
 .
Работа сил давления будет равна : A=
F1
.
Работа сил давления будет равна : A=
F1 – F2
– F2 =
p1S1
=
p1S1 –
p2S2
–
p2S2 =
p1V1
– p2V2
; но
=
p1V1
– p2V2
; но
 .
Таким образом A=p1
.
Таким образом A=p1 V
– p2
V
– p2 V.
С другой стороны(энергетическая точка
зрения )работа будет равна изменению
полной энергии системы A
= W2
– W1=(
V.
С другой стороны(энергетическая точка
зрения )работа будет равна изменению
полной энергии системы A
= W2
– W1=( +
+ )
– (
)
– ( +
+ ). С учетом выражений
). С учетом выражений
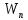 и
и
 ; A=
mgh2+
; A=
mgh2+ – mgh1
–
– mgh1
–
 ;
p1
;
p1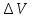 –
p2
–
p2 = mgh2
+
= mgh2
+ – mgh1
–
– mgh1
–
 . расположим слагаемые с одинаковыми
индексами в одной части выражения :p1
. расположим слагаемые с одинаковыми
индексами в одной части выражения :p1 +
mgh1+
+
mgh1+ =p2
=p2 +mgh2
+
+mgh2
+ ;
Разделим обе части на
;
Разделим обе части на :p1
+
:p1
+ gh1
+
gh1
+ =p2+
=p2+ gh2
+
gh2
+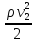 ; p+
; p+ gh+
gh+ =const
–ур-ние Бернулли, где р – статическое
давление,
=const
–ур-ние Бернулли, где р – статическое
давление,
 gh
– гидростатическое давление,
gh
– гидростатическое давление,
 – динамическое давление. Правило
Бернулли : давление в движущейся жидкости
тем меньше чем выше ее скорость .
– динамическое давление. Правило
Бернулли : давление в движущейся жидкости
тем меньше чем выше ее скорость .
30.
Вынуж.колеб.системы.Аплитуда
вынуж.колед.Резонанс. Колеб., происход.
под действием внешней силы, наз. вынужден.
колебан. Внешняя периодич. сила,
называемая вынуждающ., сообщает
колебат.сист. дополнит. энергию, которая
идет на восполнение энергетиче. потерь,
происходящ. из-за трения. .Частота
вынужден. колеб.=частоте вынуждающ.силы.
В случ., когда частота вынуждающ. силы
υ совпадает с собст. частотой колеба.сист.
υ0, происходит резкое возрастан. амплитуды
вынужден.колебаний — резонанс. Амплитуда
вынуж. колеб., зависит от частоты
вынуждающ.силы и коэффициента затухания.
Fв=F0* .Урав.вынуж.колеб.:
.Урав.вынуж.колеб.:
 х/
х/ +2ß*dх/dt+w
+2ß*dх/dt+w х=
х= t.Амплитуда
вынуж.колеб.:А=F0/
t.Амплитуда
вынуж.колеб.:А=F0/ .
Арез=F0/2ßWрез. Wрез=
.
Арез=F0/2ßWрез. Wрез=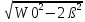
18. Си́ла Кориоли́са — одна из сил инерции, существующая в неинерциальной системе отсчёта из-за вращения и законов инерции, проявляющаяся при движении в направлении под углом к оси вращения. Если тело движется во вращающейся сист.отсчета, то кроме центробежной силы на нее также действует сила Кориолиса. Переместить некоторое тело вдоль радиуса так, чтобы оно оставалось на радиусе можно, увеличив скорость тела, то есть придав ему ускорение. Если система отсчёта вращается вместе с диском, то видно, что тело «не хочет» оставаться на радиусе, а «пытается» уйти влево — это и есть сила Кориолиса. Если воспользоваться обозначениями векторного анализа, то fk определится через векторное произведение векторов v(линейная скорость), и ω(угловая скорость):fk = 2[v × ω] m. fk = 2 m v ω sin α. Сила Кориолиса проявляется при движениях по поверхности земного шара, обладающего определённой угловой скоростью, благодаря суточному вращению. Предположим, например, что поезд идёт в северном полушарии в меридиональном направлении на север .При этом вектор относительной скорости v, составляет острый угол α с вектором угловой скорости ω, и кориолисова сила fk направлена касательно к земной поверхности направо, если встать лицом по ходу движения поезда. Поезд оказывает на правый рельс большее давление, чем на левый. В южном полушарии, при движении поезда к югу v, составит с ω тупой угол, и сила Кориолиса направлена налево относительно хода движения. Существованием силы Кориолиса объясняются подмывание реками в северном полушарии правого, а в южном - левого берегов (закон Бера), возникновение северо-восточных пассатов в северном полушарии и т. д.
