
- •Лабораторный практикум
- •Краткая теория.
- •1. 1. Общие сведенья об атомах и атомных ядрах.
- •1.2. Явление радиоактивности. Виды радиоактивных
- •2.1. Природный радиационный фон и искусственные
- •Естественные радиоактивные элементы.
- •Cхемы радиоактивного распада ядер урана и тория
- •Искусственные источники радиации
- •Добыча полезных ископаемых.
- •Профессиональное облучение.
- •Тепловые электростанции
- •Искусственные радионуклиды.
- •Удобрения и строительные материалы.
- •Другие источники облучения.
- •3.1. Общая характеристика взаимодействия радиоактивных излучений с веществом.
- •3. 2. Основные дозиметрические понятия и величины Доза излучения
- •Мощности дозы излучения.
- •3.3. Основной закон радиоактивного распада. Период полураспада.
- •3.4. Активность и единицы ее измерения. Удельная, объемная и поверхностная активность.
- •4.1. Детекторы и их типы. Основные принципы детектирования ионизирующих излучений.
- •Назначение и классификация приборов радиационного контроля.
- •Экспериментальная часть.
- •Расчетная часть.
- •Результаты работы.
- •2.Включение и режимы работы
- •Результаты работы.
- •Вопросы для самоконтроля (ответы см. Пунктах 2.1;3.2).
- •Упражнение 3. Тема: Природный радиационный фон и методы его измерения.
- •Определение годовой эквивалентной дозы гамма-излучения дозиметром рксб - 104.
- •Измерения. Таблица измеренных величин.
- •Расчетная часть.
- •Результаты работы.
- •Вопросы для самоконтроля (ответы см. Пунктах 2.1;3.2).
- •Упражнение 4. Тема: Основы радиометрии бета-излучения.
- •Измерение удельной активности радионуклида цезий-137. Измерение. Таблица измеренных величин.
- •Расчетная часть.
- •Результаты работы.
- •Вопросы для самоконтроля (ответы см. Пунктах 1.2;3.1;3.3;3.4;4.1).
- •Упражнение 5. Основные методы и средства обнаружения и регистрации ионизирующих излучений.
- •Приборы и принадлежности.
- •Измерения
- •2.2.4. Выводы
- •Вопросы для самоконтроля (ответы см. Пунктах 1.1;1.2;3.1;4.1).
- •Упражнение 6.
- •3.Результаты работы.
- •4.1. Выводы
- •Вопросы для самоконтроля (ответы см. Пунктах 1.2;3.1;3.3;3.4;4.1).
Лабораторный практикум
по радиационной безопасности
Краткая теория.
1. 1. Общие сведенья об атомах и атомных ядрах.
В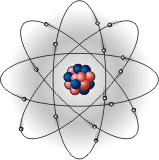 1911 году, английский учёный Эрнест
Резерфорд предложил "планетарную"
модель атома, согласно которой в центре
атома расположено крохотное, но очень
плотное ядро, в котором сосредоточена
почти вся масса атома, а электроны
вращаются вокруг него по определённым
орбитам,
как планеты вокруг Солнца (рис.1). Именно
этой моделью пользуются до сегодняшнего
дня.
1911 году, английский учёный Эрнест
Резерфорд предложил "планетарную"
модель атома, согласно которой в центре
атома расположено крохотное, но очень
плотное ядро, в котором сосредоточена
почти вся масса атома, а электроны
вращаются вокруг него по определённым
орбитам,
как планеты вокруг Солнца (рис.1). Именно
этой моделью пользуются до сегодняшнего
дня.
В ядре сосредоточена практически вся масса атома (99,95%). При Рис.1 обычных условиях атом является электрически нейтральным, так как положительный заряд ядра компенсируется отрицательным зарядом электронов.
Размеры
атомов, так же как и их масса, чрезвычайно
малы, и составляют около 1 нм (1·10-9
м).
Электроны очень лёгкие, почти невесомые,
имеют отрицательный заряд (заряд
электрона условно равен -1,
соответствует
элементарному заряду
qe=![]() ).
).
Атомное ядро любого химического элемента состоит из положительно заряженных протонов и не имеющих электрического заряданейтронов. Заряд протона по абсолютной величине равен заряду электрона. Протон и нейтрон являются двумя зарядовыми состояниями ядерной частицы, которая называетсянуклоном. Внутри ядра протоны и нейтроны способны к взаимному превращению, однако количество протонов и нейтронов в ядре всегда величина постоянная для данного нуклида и является его важной характеристикой. Массовым числомА называется общее число нуклонов в ядре. Массовые числа нейтрона и протона одинаковы и равны 1а.е.м..
Число протонов в ядре равно числу электронов и называется зарядовым числом Z, оно совпадает с порядковым номером (атомным номером) атома данного химического элемента в периодической системе Менделеева:
№пор= Z .
Чтобы определить число нейтронов N надо от массового числа A отнять атомный номер Z (или зарядовое число):
N = A − Z.
Нуклиды
обозначаются в общем виде следующим
образом:
![]() или
или![]() ,
гдеХ– символ химического элемента,А– массовое число,Z- зарядовое число или атомный номер.
Например,
,
гдеХ– символ химического элемента,А– массовое число,Z- зарядовое число или атомный номер.
Например,![]() ,
,![]() ,
,![]() и т.д.
и т.д.
Электроны, движущиеся вокруг ядра, сгруппированы в электронные слои, каждый из которых содержит электроны с близкими значениями энергии.
Ядра элементов весьма устойчивы. Это значит, что кроме кулоновских сил отталкивания между протонами в ядре действуют и значительные силы притяжения, которые называют ядерными. Ядерные силы имеют следующие основные особенности:
Они действуют только на очень коротких расстояниях порядка размера самого ядра и за его пределами равны нулю.
Ядерные силы в сотни и тысячи раз превышают все другие известные в природе взаимодействия.
Они действуют независимо от заряда нуклона.
Они имеют свойства насыщения: каждый нуклон взаимодействует только с соседним с ним нуклонами, и при увеличении количества нуклонов в ядре, ядерные силы не возрастают.
5.
Ядерные силы обладают особой обменной
природой, не имеющей аналогий в
классической физике. Согласно теории,
нуклоны в ядре удерживаются вместе
путем непрерывного обмена особыми
элементарными частицами, которые
называются квантами ядерного поля или
![]() -мезонами.
Время обмена составляет~10–23
с.
-мезонами.
Время обмена составляет~10–23
с.![]()
Устойчивость атомных ядер, изотопы.
Химические свойства любого элемента не зависят от массового числа; т. к. они определяются строением электронных оболочек атома (следовательно, и Z). С другой стороны, массовое число имеет решающее значение для ядерной стабильности радиоактивных свойств атома. Для стабильных ядер отношение количества нейтронов N к количеству протонов Z равно единице: N / Z = 1, ядра для которых N / Z больше или равно 1,5 являются нестабильными.
Так,
например, для изотопа
![]() отношение
отношение![]() =1,271, а для изотопа
=1,271, а для изотопа![]() данное отношение уже равно 1,598. Такая
перегруженность ядер нейтронами и
возрастание сил кулоновского отталкивания
приводит к потере прочности ядра и
поэтому все известные изотопы химических
элементов сZ
данное отношение уже равно 1,598. Такая
перегруженность ядер нейтронами и
возрастание сил кулоновского отталкивания
приводит к потере прочности ядра и
поэтому все известные изотопы химических
элементов сZ
![]() являются радиоактивными.
являются радиоактивными.
Для
радиоактивных изотопов элементов,
находящихся в начале и середине таблицы
Менделеева, такой закономерности не
обнаружено. Вместе с тем, для таких
достаточно широко распространенных
радионуклидов как
![]()
![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() и др. соотношение нейтронов к протонам
колеблется в пределах от 1,1 для
и др. соотношение нейтронов к протонам
колеблется в пределах от 1,1 для![]() до 2 для
до 2 для![]() .
.
Изотопы – атомы, которые имеют одинаковый атомный номер Z (одинаковый заряд ядер) и разные массовые числа. Они идентичны по химическим свойствам, но различаются по характеру радиоактивности. В таблице Менделеева более 100 химических элементов. Почти каждый из них представлен смесью стабильных и радиоактивных атомов, которые называют изотопами данного элемента. Известно около 2000 изотопов, из которых около 300 - стабильных.
Например,
углерод встречается в виде смеси
трех изотопов -
![]() ,
,![]() ,
,![]() ,
ядра которых содержат 6 протонов и,
соответственно, 6, 7 и 8 нейтронов.
,
ядра которых содержат 6 протонов и,
соответственно, 6, 7 и 8 нейтронов.
Изотопы имеют одинаковый символ и определяются общим названием элемента с добавлением к нему массового числа. Например, углерод – 12, калий – 40, уран – 235 и т.д.
Радиоактивные изотопы обычно называют радионуклидами.
