
Молекулярная физика
.pdf
Статическая физика и термодинамика.
Статический способ описания - изучает св-ва тел из свойств образующих его частиц
Макроскипические параметры - давление, объем, температура Уравнение состояния идеального газа
Температура является количественной мерой нагретости тела Рабита при адиабатическом процессе:
Рабита при изобарном процессе:
Рабита при изотермическом процессе:

при изохорном процессе газ работы не совершает
Идеальный газ - модель реального газа, взаимодействием между молекулами которого можно пренебречь, еще принебрешгают объемом молекул
Изотермический процесс - температура является постоянной величиной
Изобарный процесс - давление является постоянной величиной
Изохорный процесс - объем является постоянной величиной
Уравнение изотермического процесса - P1V1=P2V2
Уравнение изобарного процесса - V1/T1=V2/T2
уравнение изохорного процесса - P1/T1=P2/T2
Закон Дельтона если газ состоит из смеси газов то - P(смеси)=P1+P2+...+P(n)
Закон Авагардо - в равных объѐмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул
Уравнение кинетической теории газов - P=2*n*E/3

E(средяя)=3*k*T/2
Теорема о равнораспределении утверждает, что при тепловом равновесии, любая степень свободыкоторая появляется только как квадратичная функция в энергии, обладает средней энергией равной ?k*T
Средняя квадратичная скорость равна sqrt((3*k*T)/m)
Распределение Больцмана - n=n(0)*exp*(-E(p)/kT)
Теплоѐмкость тела — физическая величинаравная количеству теплоты которое нужно сообщить телу, чтобы повысить его температуру на 1 градус
Длина свободного пробега молекулы — это среднее расстояние, которое частица пролетает за время свободного пробега от одного столкновения до следующего
где  - эффективное сечение молекулы,n - концентрация молекул.
- эффективное сечение молекулы,n - концентрация молекул.
Барометрическая формула зависимость давления или плотности газа от высоты в поле тяжести:

Молярная теплоемкость - теплоемкость одного моля
Удельная теплоемкость - теплоемкоксть единицы массы вещества Внутренняя эергия идеального газа:
Политропический процесс - удельная теплоѐмкость газа остаѐтся неизменной:
Показатель политропы(n):
При адиабатическом процессе не происходит теплообмена Показатель адиабаты:

Явление переноса
Наука изучающая процессы при нарушении равновесия называется физическая кинетика.
нарушуние равновесия может сопровождаться потоком молекул, теплоты, или эл. заряда
Диффузия— процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объѐму. D=(1/3)*v*лямда в скобках тега
Теплопроводность — это процесс переноса внутренней энергии от более нагретых частей тела к менее нагретым частям, осуществляемый хаотически движущимися частицами тела.
Закон теплопроводности Фурье

где q — вектор плотности теплового потока — количество энергии, проходящей в единицу времени через единицу площади, перпендикулярной каждой оси, x — коэффициент теплопроводности.Минус в правой части показывает, что тепловой поток направлен противоположно вектору grad T.
Вязкости— одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Первое начало термодинамики - термодинамическая система может совершать работу только за счѐт своей внутренней энергии или каких-либо внешних источников энергии
Для изотермического процесса:
Для изобарного процесса:
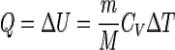
Для изохорного процесса:
Равновсный процесс - процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных состояний.
Процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений
Энтропия - мера вероятности осуществления какого-либо макроскопического состояния
Второе начало термодинамики - невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему
Третье начало термодинамики - приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система
Коэффициент полезного действия

где А — полезная работа, а Q — затраченная энергия.
КПД тепловой машины:
КПД тепловой машины Карно
Уравнение Ван-дер-Ваальса для одного моля:
V - молярный объѐм Для ню молей:

V - объѐм
Перегртая жикость — жидкость, нагретая выше температуры кипения
Переохлаждение пара — охлаждение пара ниже температуры его сублимации
При фазовом переходе первого рода скачкообразно изменяются: удельный объѐм, количество запасѐнной внутренней энергии, концентрация компонентов
При фазовом переходе второго рода плотность и внутренняя энергия не меняются
Фаза — термодинамически равновесное состояние вещества
Тройная точка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов

Сублимация — переход вещества из твѐрдого состояния в газообразное без пребывания в жидком состоянии
Ближний порядок это наличие закономерности в расположении соседних атомов или молекул.
