
Laboratorki_po_khimii / 8
.doc
1 Лабораторная работа №9
Определение молярной массы неэлектролита криоскопическим методом
Цель работы: на опыте наблюдать проявление коллигативных свойств разбавленных растворов неэлектролитов, определить молярную массу глюкозы по понижению температуры замерзания ее раствора.
Оборудование и реактивы: прибор для определения температуры замерзания (рис.1): штатив с лапкой, стакан на 50 – 100 мл или пробирка большого диаметра, большой стакан для охладительной смеси, две мешалки с кольцами различных диаметров, термометр Бекмана, термометр с нулем в середине шкалы; технохимические весы с разновесом, мерный цилиндр, ложка, шпатель, снег (толченый лед), хлорид натрия для охладительной смеси, глюкоза или мочевина, дистиллированная вода.
1.1 Теоретические пояснения
Свойства растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенного вещества, называются коллигативными.
К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания (кристаллизации) раствора, повышение температуры кипения раствора по сравнению с чистым растворителем, осмос.
Коллигативные свойства растворов могут проявляться в полной мере лишь в идеальных растворах, в которых нет химического взаимодействия между компонентами, а силы межмолекулярного взаимодействия между частицами растворителя, с одной стороны, и частицами растворенного вещества, с другой стороны, одинаковы. Образование таких растворов не сопровождается тепловым эффектом, и каждый компонент ведет себя независимо от других.
Разбавленные растворы нелетучих неэлектролитов приближаются по своим свойствам к идеальным растворам. Для них можно использовать количественные закономерности, полученные для идеальных растворов.
Согласно следствию из закона Рауля, раствор замерзает при более низкой температуре, чем чистый растворитель. Понижение температуры замерзания раствора DТзам. пропорционально моляльной концентрации раствора b:
DТзам.=Кк × b, (1.1)
где Кк – криоскопическая постоянная растворителя.
Криоскопическая постоянная не зависит от природы растворенного вещества, а зависит только от природы растворителя. Для воды Кк=1,86 К×кг/моль.
Понижение температуры замерзания раствора можно использовать для определения молярной массы растворенного неэлектролита.
Моляльность раствора можно вычислить по формуле:
![]() , (1.2)
, (1.2)
где m1 – масса растворенного вещества, г;
m2 – масса растворителя, г;
М – молярная масса растворенного вещества, г/моль;
1000 – коэффициент пересчета от граммов растворителя к килограммам.
При подстановке выражения (1.2) в формулу (1.1) получаем:
DТзам.=Кк
×![]() . (1.3)
. (1.3)
Из выражения(1.3) можно выразить молярную массу неэлектролита:
![]() . (1.4)
. (1.4)
1.2 Методика проведения опыта
Прибор для криоскопических опытов представлен на рисунке 1.1. Он состоит из пробирки (1) с боковым отростком (2). Пробирка закрыта резиновой пробкой (3) с двумя отверстиями: в одно отверстие вставлен термометр Бекмана (4), а в другое мешалка (5). Термометр Бекмана заранее настраивается на нужный температурный интервал преподавателем или лаборантом. Пробирку с термометром и мешалкой вставляют в широкую пробирку (6), которая служит воздушным холодильником и обеспечивает равномерное охлаждение раствора. Широкую пробирку вставляют в отверстие крышки (7), которой закрывают толстостенный стеклянный сосуд (8) с охлаждающей смесью. В другое отверстие крышки вставляют мешалку (9) для перемешивания охлаждающей смеси.
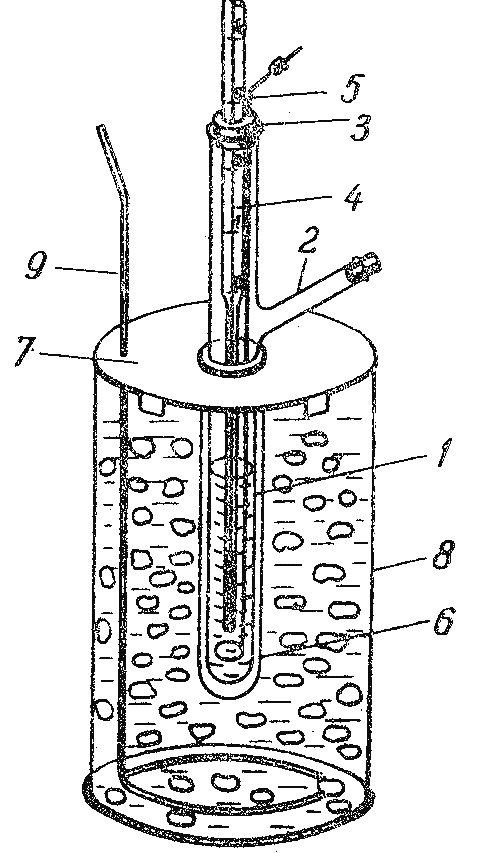
Рисунок 1.1 – Прибор для определения температуры замерзания
При выполнении опыта придерживаются следующей последовательности действий.
1.2.1 Заполнить сосуд (8) охлаждающей смесью, состоящей из трех частей снега (толченого льда) и одной части хлорида натрия. Температура охладительной смеси должна быть -3 ¾ -5 0С. Ее можно регулировать при помощи изменения соотношения снега (льда) и соли.
1.2.2 Отмерить 40 мл дистиллированной воды и влить в пробирку (1).
1.2.3 Укрепить термометр так, чтобы он входил в кольцо мешалки, а ртутный шарик был полностью закрыт жидкостью.
1.2.4 Все время перемешивая воду мешалкой, определить по температуре замерзания воды нулевую точку термометра. Нужно иметь в виду, что жидкость часто переохлаждается. Поэтому температурой замерзания чистой воды следует считать ту температуру, которая устанавливается в момент замерзания после некоторого скачка вверх.
1.2.5 Вынуть пробирку (1) из прибора, растопить лед и еще раз определить температуру замерзания воды.
1.2.6 Взвесить на технохимических весах 3,6 г глюкозы (С6Н12О6) или 1,2 г мочевины (CO(NH2)2), растворить вещество в воде, находящейся в пробирке (1).
1.2.7 Поместить пробирку в прибор, установить термометр. Постоянно перемешивая раствор глюкозы (мочевины), определить температуру его замерзания. Под температурой замерзания следует понимать температуру начала замерзания, так как процесс замерзания раствора, в отличие от чистого растворителя, протекает при постепенно понижающейся температуре. Повторить измерение еще раз.
1.2.8 Рассчитать молярную массу глюкозы по формуле (1.4).
1.2.9 Результаты опыта и расчетов занести в таблицу 1.1.
1.2.10 Сопоставить данные расчетов с теоретическим значением молярной массы глюкозы. Рассчитать относительную погрешность опыта по формуле (1.5).
e(%)=![]() . (1.5)
. (1.5)
Таблица 1.1 – Результаты опыта
|
Масса растворите-ля, г |
Температура замерзания растворителя, 0С |
Масса глюкозы, г |
Температура замерзания раствора, 0С |
Молярная масса глюкозы, г/моль |
|
|
теорети-ческая |
экспери-ментальная |
||||
|
|
1. 2. Среднее значение |
|
1. 2. Среднее значение |
|
|
1.3 Примеры решения задач
Пример 1
В каких объемных отношениях нужно взять воду и глицерин (С3Н5(ОН)3), чтобы приготовленный из них антифриз замерзал примерно при –15 0С? Плотность глицерина равна 1261 г/л.
Решение
Антифризами называют растворы с пониженной температурой замерзания, применяемые в системах охлаждения.
В соответствии со следствием из закона Рауля, понижение температуры замерзания раствора по сравнению с чистым растворителем пропорционально моляльной концентрации растворенного неэлектролита:
DТзам.=Кк × b.
По условию задачи DТзам.=00С – (-150С) = 150С.
Зная криоскопическую постоянную воды (1,86 К× кг/моль), можно найти моляльность раствора глицерина:
![]() =8,06
(моль/кг).
=8,06
(моль/кг).
Иными словами, в одном килограмме воды содержится 8,06 моль глицерина, масса которого равна:
m![]() =
=![]() =8,06
(г)
×
92 (г/моль)
»
742 (г)
=8,06
(г)
×
92 (г/моль)
»
742 (г)
Принимая во внимание, что плотность воды при комнатной температуре близка к 1000 г/л, а плотность глицерина равна 1261 г/л, от масс можно перейти к объемам:
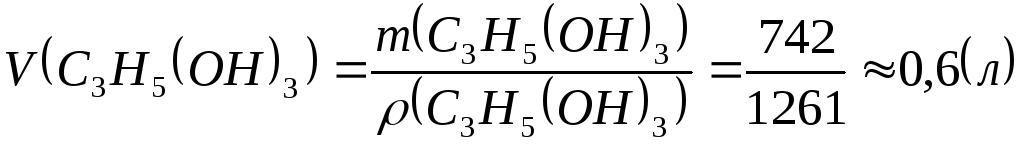 ,
,
![]() .
.
Отношение объемов воды и глицерина равно 1:0,6=10:6=5:3.
Итак, на 5 объемов воды нужно взять 3 объема глицерина.
Пример 2
При какой температуре будет кипеть 20% раствор сахара (С12Н22О11)? Эбуллиоскопическая постоянная воды равна 0,513 К× кг/моль.
Решение
Повышение температуры кипения раствора неэлектролита по сравнению с чистым растворителем пропорционально моляльности раствора:
DТкип.=Кэб. × b.
Рассчитаем моляльность раствора. В 1000 граммах 20% раствора содержится 200 г сахара и 800 г воды. Найдем количество вещества сахара в 800 г воды:
![]() .
.
Вычислим моляльность раствора:
![]() .
.
DТкип.=Кэб. × b=0,513 × 0,73» 0,4 (0С),
Чистая вода при давлении 1 атм. кипит при 100 0С, 20% раствор сахара будет кипеть при температуре, на 0,4 градуса выше, чем чистый растворитель, то есть при 100,4 0С.
1.4 Требования к уровню подготовки студентов
-
Знать коллигативные свойства растворов: понижение давления насыщенного пара растворителя, повышение температуры кипения, понижение температуры замерзания растворов, осмос.
-
Знать закон Рауля и следствия из него, закон Вант-Гоффа для осмотического давления.
-
Уметь использовать эти законы для вычисления давления насыщенного пара растворителя над раствором, понижения температуры замерзания и повышения температуры кипения растворов, величины осмотического давления.
1.5 Задания для самоконтроля
1.5.1 При одинаковой ли температуре замерзает речная и морская вода? Почему?
1.5.2 Почему тротуары зимой посыпают солью?
1.5.3 При растворении 2,76 г некоторого неэлектролита в 200 г воды температура замерзания понизилась на 0,276 0С. Вычислить молярную массу вещества.
1.5.4 Смешали 20 литров воды и 7 литров глицерина (С3Н5(ОН)3). Вычислить температуру замерзания раствора, если плотность глицерина равна 1261г/л, а криоскопическая постоянная воды – 1,86 К× кг/моль.
1.5.5 Водный раствор, содержащий неэлектролит, замерзает при 271 К. Определить температуру кипения раствора, если криоскопическая постоянная воды равна 1,86 К× кг/моль, а эбуллиоскопическая постоянная– 0,513 К× кг/моль.
1.5.6 Определить температуру кипения 25% водного раствора сахара (С12Н22О11). Эбуллиоскопическая постоянная воды равна 0,513 К× кг/моль.
1.5.7 Как называются растворы глюкозы и глицерина, обладающие одинаковым осмотическим давлением при одной и той же температуре: а) гипертонические; б) гипотонические; в) изотермические; г) изотонические?
1.5.8 Какова молярная масса вещества, 24,731 г которого растворено в 1 л воды, если раствор замерзает при –0,5 0С, а криоскопическая постоянная для воды равна 1,86?
1.5.9 Для какого из перечисленных растворов: а) в 800 мл раствора содержится 7,44 г анилина С6H5NH2; б) в 600 мл раствора содержится 50 г сахарозы С12Н22О11; в) в 200 мл раствора содержится 1,84 г глицерина С3Н8О3; г) в 900 мл раствора содержится 48,6 г фруктозы С6Н12О6 – осмотическое давление будет максимально при заданной температуре?
1.5.10 При какой температуре замерзает раствор, состоящий из 7,42 г глицерина С3Н8О3 и 300 мл воды, если криоскопическая постоянная воды равна 1,86?
1.5.11 Во сколько раз повысится осмотическое давление раствора при нагревании от 70С до 630С?
1.5.12 При какой температуре кипит раствор, состоящий из 30 г мочевины CO(NH2)2 и 500 мл воды, если эбуллиоскопическая постоянная воды равна 0,52?
1.5.13 Какова моляльная концентрация водного раствора неэлектролита, если он кипит при 101,04 0С? Эбуллиоскопическая постоянная воды равна 0,52.
1.5.14 В 1 л воды растворили при заданной температуре 10 г неэлектролита. При растворении какого из перечисленных веществ: глюкоза С6Н12О6; глицерин С3Н8О3; сахароза С12Н22О11; мочевина СО(NH2)2 – давление насыщенного пара воды понизится максимально?
1.6 Список рекомендуемой литературы
1.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 1998. – С. 204 – 208.
1.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2002. – С. 225 – 230.
1.6.3 Любимова.Н.Б. Вопросы и задачи по общей и неорганической химии. – М.: Высш. шк., 1990. – С. 191 – 194.
1.6.4 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 2002. – С. 105 – 110.
