
Порядок химической реакции [править]
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
Кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение:
![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
![]()
Период полупревращения:
![]()
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]()
или
![]()
В первом случае скорость реакции определяется уравнением
![]()
Линейная форма уравнения:
![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
![]()
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Период полупревращения (для случая равных начальных концентраций!):
![]()
Устойчивость комплексов
Резкой границы между комплексными соединениями и двойными солями провести нельзя.
Диссоциация проходит по стадиям.
![]() I
стадия
I
стадия
как сильный электролит, т.е. полностью комплексный ион ионизирует полностью:
I ступень
![]()
![]()
II ступень
![]()
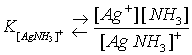
![]()
Константа нестойкости – это К I ступени + К II ступени.
Это константа нестойкости или константа распада комплекса.
Обратная величина константы нестойкости называется константой устойчивости.
![]()
Комплексонометрия (трилонометрия) — титриметрический метод, основанный на реакциях образования комплексных соединений ионов металлов сэтилендиаминтетрауксусной кислотой и другими аминополикарбоновыми кислотами (комплексонами). Большинство ионов металлов взаимодействуют с комплексонами практически мгновенно с образованием растворимых в воде малодиссоциированных соединений постоянного состава. Метод позволяет определять практически все катионы и многие анионы. Комплексонометрия является составной частью комплексиметрии (хелатометрии).
3.
АЦЕТОУКСУСНЫЙ
ЭФИР (этиловый
эфир ацетоуксусной
к-ты, этилацетоацетат), мол. м. 118,14;
бесцв. жидкость;
т. пл. -45°С, т. кип. 180,8°С (с разл.), 100°С/80
мм рт. ст., 71°С/12,5мм рт.ст.; d420 1,0284,
nD20 1,4198;
раств. в воде (14,3%
при 16,5°С), этаноле,
эфире. Существует в двух таутомерных
формах - кетонной (а)и енольной (б):
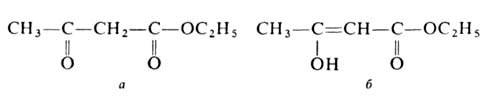
Енольная форма стабилизируется за счет сопряжения двойной углерод-углеродной связи с карбонильной группой и образования внутримолекулярной водородной связи между гидроксилом и карбонилом. Кетонную форму можно выделить вымораживанием, енольную -фракционной перегонкой в кварцевой посуде в вакууме; для них т. пл. соотв. -39 и -44°С, d420 1,0368 и 1,0119, nD20 1,4425 и 1,4480. Соотношение таутомеров зависит от природы р-рителя, материала сосуда, т-ры, напр. в ацетоуксусном эфире при комнатной т-ре содержится 7,5% енола, при 18°С в р-рах ацетоуксусног эфира в воде, этаноле, эфире и циклогексане - соотв. 0,4, 12, 27,1 и 46,4%. Чистые таутомерные формы сохраняются в кварцевой посуде при -80°С.
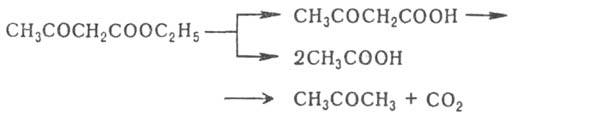
Под
действием разб. р-ров к-т
или щелочей ацетоуксусный
эфир подвергается расщеплению с
образованием ацетона (т.
н. кетонное расщепление), под действием
конц. р-ров щелочей -
с образованием уксусной к-ты (кислотное
расщепление):
Как кетон ацетоуксусный
эфир восстанавливается Н2 in
situ до этил![]() гидроксибутирата;
присоединяет, напр., HCN, NaHSO3 с
образованием соотв.циангидрина и
гидросульфитного производного. Р-ция
с фенилгидразином сопровождается циклизацией фенилгидразона
ацетоуксусного эфира:
гидроксибутирата;
присоединяет, напр., HCN, NaHSO3 с
образованием соотв.циангидрина и
гидросульфитного производного. Р-ция
с фенилгидразином сопровождается циклизацией фенилгидразона
ацетоуксусного эфира:

Как енол ацетоуксусный
эфир мгновенно обесцвечивает р-р
Вг2 (р-ция
служит для количеств. определения енола),
с Fed, образует комплекс красно-фиолетового
цвета, с РС15-![]() хлоркротоновый
эфир СН3СС1=СНСООС2Н5.
Ацетилируется хлорангидридами к-т:
хлоркротоновый
эфир СН3СС1=СНСООС2Н5.
Ацетилируется хлорангидридами к-т:

При действии на ацетоуксусный эфир металлич. Na или алкоголятов Na в спиртовом р-ре получается натрийацетоуксусный эфир CH3C(ONa)—СНСООС2Н5, широко используемый в р-циях с алкилгалогенидами, приводящих к образованию алкил- и диалкилацетоуксусных эфиров-соответственно CH3COCH(R)COOC2H5 и CH3COC(RR')COOC2H5. Кетонное и кислотное расщепление последних происходит так же, как и ацетоуксусного эфира. Напр., при кетонном расщеплении метилацетоуксусного эфира получается метилэтилкетон, при кислотном - уксусная и пропионовая к-ты. В зависимости от характера реагента, природы р-рителя и условий из натрийацетоуксусного эфира могут получаться как С-, так и О-производные ацетоуксусного эфира.
Атомы Н
метиленовой группы ацетоуксусного
эфира очень подвижны, благодаря чему
он реагирует, напр., с альдегидами:
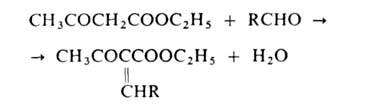
вступает в р-цию Михаэля и др. В пром-сти и лаборатории ацетоуксусный эфир получают действием металлич. Na на этилацетат (см. Клайзена конденсация]. Образующийся натрийацетоуксусный эфир действием разб. минер. к-т переводят в ацетоуксусный эфир. Применяют ацетоуксусный эфир в синтезе лек. ср-в (напр., амидопирина, антипирина, акрихина), витамина В1, красителей, содержащих пиразолоновый цикл; как ароматизирующее в-во для пищ. продуктов. Ацетоуксусный эфир раздражает кожу. Т. всп. 85оС.
