
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №1
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №2
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №3
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №4
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №5
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №6
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №7
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №8
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №9
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №10
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №11
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №12
- •Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №13
Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №11
При некоторой температуре константа равновесия реакции
ZnO(т)+CO(г)![]() Zn(т)+CO2(г)
равна 0,5. Определите равновесную кон-
Zn(т)+CO2(г)
равна 0,5. Определите равновесную кон-
центрацию СО2 (моль/л), если начальная концентрация СО – 6 моль/л.
Как изменятся скорости прямой и обратной реакций Н2 + Cl2
 2HCl
если при неизменной температуре в одном
случае уменьшить концентрацию каждого
вещества в 2 раза, а в другом – увеличить
давление в 3 раза?
2HCl
если при неизменной температуре в одном
случае уменьшить концентрацию каждого
вещества в 2 раза, а в другом – увеличить
давление в 3 раза?Действием каких факторов можно сместить равновесие указанных реакций вправо?
а) C
+ H2O(г)
![]() СО
+ Н2
– 129,89 кДж.
СО
+ Н2
– 129,89 кДж.
б) N2
+ 3H2
![]() 2
NH3
+ 92,18 кДж
2
NH3
+ 92,18 кДж
Ответ поясните.
Энергия активации реакции 2SO2 + O2
 2SO3
при
температуре Т=4500С
равна Еа=280кДж/моль.
При применении платинового катализатора
энергия активации уменьшается до 68
кДж/моль. Оцените, во сколько раз
увеличивается константа скорости
каталитической реакции при данной
температуре.
2SO3
при
температуре Т=4500С
равна Еа=280кДж/моль.
При применении платинового катализатора
энергия активации уменьшается до 68
кДж/моль. Оцените, во сколько раз
увеличивается константа скорости
каталитической реакции при данной
температуре.
Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №12
Определите численное значение константы равновесия приведенной ниже реакции, если даны исходные концентрации (моль/л): [N2]=3; [H2]=4, а к моменту равновесия прореагировало 75% Н2.
N2
+3H2
![]() 2NH3
2NH3
Константа скорости реакции А+2В=АВ2 равна 2.10-3 л/моль.с.
а) Какова скорость
![]() указанной реакции в начальный момент
времени, если концентрация вещества А
равна концентрации вещества В и составляет
0,4 моль/л?
указанной реакции в начальный момент
времени, если концентрация вещества А
равна концентрации вещества В и составляет
0,4 моль/л?
б) Какова будет
скорость этой реакции
![]() через некоторое времяt,
если к этому моменту образуется 0,1 моль/л
вещества АВ2.
через некоторое времяt,
если к этому моменту образуется 0,1 моль/л
вещества АВ2.
Напишите выражение для константы равновесия гомогенной системы СН4 + СО2
 2СО
+ 2Н2.
Как следует изменить температуру и
давление, чтобы повысить выход водорода?
Прямая реакция – образование водорода
- эндотермическая. Ответ
поясните.
2СО
+ 2Н2.
Как следует изменить температуру и
давление, чтобы повысить выход водорода?
Прямая реакция – образование водорода
- эндотермическая. Ответ
поясните.Пероксид водорода разлагается в водных растворах на кислород и воду. Реакцию ускоряют как неорганический катализатор (ион Fe3+), так и биоорганический (фермент – каталаза). Энергия активации реакции в отсутствии катализатора 75,4 кДж/моль. Ион Fe3+ снижает ее до 42 кДж/моль, а фермент каталаза – до 2 кДж/моль. Рассчитайте соотношение скоростей реакции в отсутствие катализатора в случаях присутствия Fe3+ и каталазы. Реакция протекает при температуре 270С.
Контрольная работа по теме: «Скорость химической реакции. Химическое равновесие» Вариант №13
Как будет меняться скорость взаимодействия оксида азота (II) и кислорода при: а) увеличения давления в системе в 2 раза; б) увеличении давления NO в 2 раза; в) увеличении давления кислорода в 2 раза?
Исходные концентрации NO и Cl2 в системе 2NO+Cl2 = 2 NOCl составляют соответственно: 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
Напишите выражение для константы равновесия гетерогенной системы СО2 + С
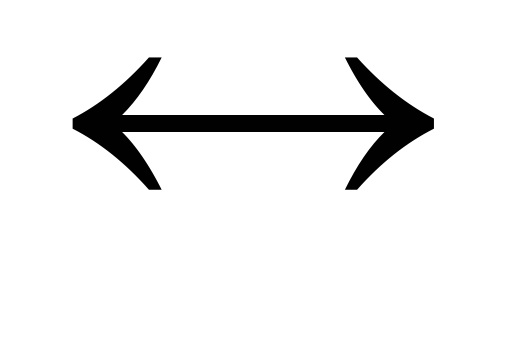 2СО.
Как следует изменить концентрацию СО2
, температуру
и давление, чтобы повысить выход СО,
если прямая реакция экзотермическая?
Ответ
поясните.
2СО.
Как следует изменить концентрацию СО2
, температуру
и давление, чтобы повысить выход СО,
если прямая реакция экзотермическая?
Ответ
поясните.Энергия активации разложения иодоводорода 2HI=H2+I2 в газовой фазе при 800 К равна 190 кДж/моль. В присутствии платины она снижается до 60 кДж/моль. Определите, во сколько раз скорость реакции в присутствии катализатора выше скорости некаталитического разложения.
