

Утверждаю
Ректор университета
____________А.В. Лагерев
«____»____________2008 г.
ХИМИЯ
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Методические указания
к выполнению лабораторной работы
для студентов всех форм обучения
всех специальностей
БРЯНСК 2008
УДК 541.8
Химия. Скорость химических реакций и химическое равновесие: методические указания к выполнению лабораторной работы для студентов всех форм обучения всех специальностей. – Брянск: БГТУ, 2008. -15 с.
Разработали: Е.В. Удовенко, асс.,
О.Г. Казаков, к.х.н., доц.,
О.Ф. Котелович, к.х. н., доц..
И.В. Ильина, к.б.н.
Рекомендованы кафедрой «Безопасность жизнедеятельности и химия» БГТУ (протокол № 5 от 22.01.08)
Научный редактор О.Г. Казаков
Редактор издательства Л.И. Афонина
Компьютерный набор Е.В.Удовенко
Темплан 2008 г., п.65
Подписано в печать Формат 60x84 1/16. Бумага офсетная. Офсетная печать. Усл. печ.л. 0,87. Уч.-изд.л. 0,87. Тираж 50 экз. Заказ Бесплатно.
Брянский государственный технический университет.
241035, Брянск, бульвар 50-летия Октября, 7, БГТУ. 58-82-49. Лаборатория оперативной полиграфии БГТУ, ул. Харьковская, 9.
ЦЕЛЬ РАБОТЫ
Цель работы - изучить и экспериментально проверить кинетические закономерности протекания химических реакций и особенности установления равновесия.
Продолжительность работы - 4 часа.
2. Теоретическая часть
2.1. Скорость химической реакции
Область химической науки, изучающая скорость химической реакции, называется химической кинетикой.
Рассмотрим вначале скорость гомогенных реакций, в которых реагирующие вещества находятся в одном агрегатном состоянии.
К рассматриваемому случаю относятся газовые реакции, например:
2NO + O2 → 2NO2,
и реакции в растворах, например:
HCI + NaOH → NaCl + H2O.
Рассмотрим гомогенную химическую реакцию в общем виде
аА+ вВ → сС + dD.
Скорость такой реакции

 .
(1)
.
(1)
При этом знак (-) ставится в случае, если скорость определяют по уменьшению концентрации исходных веществ (∆А<0), так как скорость должна быть положительной. Скорость гомогенной химической реакции зависит:
- от природы реагирующих веществ;
- концентрации исходных веществ;
- температуры;
- наличия и вида катализатора.
При этом скорость гомогенной химической реакции не зависит от объема реакционной смеси.
Зависимость скорости гомогенной химической реакции от концентрации исходных веществ дает основной закон химической кинетики - закон действующих масс: скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций исходных реагирующих веществ, взятых в некоторых степенях:
V=k[A]na[B]nв. (2)
При этом в простейшем случае, когда изучаемая реакция протекает в одну стадию, то есть так, как она записана, показатели степени при концентрациях веществ совпадают с соответствующими стехиометрическими коэффициентами уравнения реакция:
na= a; nв=в,
и закон действующих масс приобретает более простой вид
V=k[A]a[B]в. (3) Коэффициент пропорциональности k в выражении закона действующих масс есть константа скорости химической реакции. Физический смысл k следует из уравнений (2) и (3). Константа скорости химической реакции k представляет собой скорость данной реакции при концентрации исходных веществ, равных единице. Следовательно, константа скорости химической реакции k не зависит от концентраций исходных веществ, поэтому более объективно характеризует протекание реакции во времени, чем скорость V, и заменяет скорость во многих кинетических расчетах. Реагирующие вещества могут находиться в разных фазах, например
Zn + 2HCI →ZnС12 + Н2 ↑.
В реакционной системе находятся цинк - твердое вещество; раствор HCI и ZnС12, а также газообразный водород. Такая реакция называется гетерогенной.
При изучении скорости таких реакций необходимо учитывать, что если гомогенная реакция протекает во всем объеме системы (газа или раствора), то гетерогенная - на поверхности раздела фаз (в рассмотренном примере – на поверхности цинка). Поэтому кинетика гетерогенных реакций имеет свои особенности, которые будут рассмотрены ниже на примере реакций гетерогенного катализа.
Зависимость скорости химической реакции от температуры выражена очень сильно, причем практически все реакции при повышении температуры ускоряются. Количественно это влияние оценивается приближенным эмперическим правилом Вант-Гоффа: при повышении температуры на 10°С скорость (или константа скорости) большинства химических реакций возрастает в 2-4 (в среднем 3) раза.
 (4)
(4)
где γ - температурный коэффициент Вант-Гоффа.
Более строгим математическим соотношением, выражающим зависимость константы скорости химической реакции от температуры, является уравнение Аррениуса:
 или
или
 (5)
(5)
где k1 - константа скорости реакции при температуре T1, k2 - константа скорости реакции при температуре T2 (температура выражена в Кельвинах); Еa - энергетическая характеристика реакции, называемая энергией активации; k0 - константа, характеризующая природу реагирующих веществ.
Энергия активации Еa есть дополнительная избыточная энергия, которую нужно сообщить молекулам реагирующих веществ А и В, чтобы они могли вступить во взаимодействие.
Из уравнения (5) видно, что чем больше энергия активации химической реакции, тем меньше скорость (при прочих равных условиях, в частности, при одной и той же температуре).
При введении в реакционную систему определенных веществ, называемых катализаторами, скорость химической реакции изменяется. Это явление носит название катализа. Различают положительный катализ, когда скорость реакции возрастает, и отрицательный, когда катализатор замедляет реакцию. Это явление называется ингибированием, а катализатор, применяемый в отрицательном катализе, называется ингибитором. Поскольку на практике чаще всего применяют положительный катализ, слово «положительный» в этом случае опускают, и говорят просто «катализ» и «катализатор».
Катализатор – вещество, которое вступает в химическую реакцию, изменяющее ее скорость и выходящее из реакции в химически неизменном виде.
Основные черты действия катализатора следующие:
Катализатор в одинаковой степени ускоряет как прямую, так и обратную реакции, то есть его применение не может изменить положение равновесия и, следовательно, изменить выход продуктов реакции.
Катализатор обладает свойством специфичности (избирательности, селективности). Каждый катализатор ускоряет не все реакции, а только какую-то определенную группу реакций или даже одну реакцию (никель является катализатором только для реакции гидрирования, оксид ванадия (V) – для реакций окисления и т.д.).
Катализатор вступает в химическую реакцию с реагирующими веществами. Реакция протекает по стадиям, причем образуются, а затем разлагаются неустойчивые промежуточные соединения реагирующих веществ с катализатором, и в конце реакции катализатор остается в химически неизменном виде.
Одна из возможных схем действия катализатора:
А
+ В
 С + Д – без катализатора;
С + Д – без катализатора;
А
+ К
 АК;
АК;
АК
+ В
 С + Д + К – с катализатором.
С + Д + К – с катализатором.
А + В → С + Д
Однако сама по себе стадийность процесса не может быть причиной ускорения реакции. Катализатор ускоряет реакцию только в том случае, если энергия активации стадий каталитической реакции меньше энергии активации реакции без катализатора
Е1<E и E2<E.
Тогда все стадии каталитической реакции идут быстрее, чем некаталитической (чем меньше энергия активации Еа, тем выше скорость реакции). Следовательно, действие катализатора состоит в уменьшении энергии активации реакции.
Катализ может быть гомогенным (все реагирующие вещества и катализатор находятся в одной фазе) и гетерогенным (катализатор и реагирующие вещества находятся в разных фазах). Чаще всего в гетерогенном катализе катализатор – твердое вещество, реагенты – жидкости или газы.
Гетерогенные химические реакции (в том числе реакции гетерогенного катализа) имеют свои особенности, которые необходимо учитывать при изучении скорости. Все они происходят на поверхности раздела фаз (например, на поверхности твердого вещества), в то время как реагирующие вещества (жидкости или газы) находятся в реакционном объеме, поэтому такие реакции протекают по стадиям:
- подвод исходных веществ к поверхности раздела фаз, то есть к твердому телу;
- собственно химическая реакция на поверхности раздела фаз;
- отвод продуктов реакции от поверхности раздела в объем реакционной системы.
При этом скорость гетерогенной химической реакции, в отличие от скорости гомогенной химической реакции, зависит от объема реакционной смеси, а также от величины поверхности раздела фаз (в частности, поверхности твердого тела), на которой происходит реакция
V
~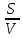 ,
,
где V – скорость гетерогенной химической реакции; S – поверхность раздела фаз; V - объем реакционной системы.
В целом кинетические особенности всей гетерогенной химической реакции (в частности, ее скорость) определяются по той из стадий процесса, которая протекает наиболее медленно, с наибольшим затруднением. Такая стадия, определяющая скорость всего процесса, называется лимитирующей.
