
Общая химия (АиАХ, ПТМ, ПТЭ, РС, МиТЭ) / методические указания / термодинамика
.doc3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Работа выполняется звеньями из 2-3 студентов.
Опыт №1. Определение теплоты нейтрализации.
Упрощенный калориметр состоит из двух стаканов. В большой стеклянный стакан вставьте другой стакан меньшего размера. Они не должны между собой соприкасаться. Во избежание потерь теплоты через стенки внутреннего калориметрического стакана между ними поместите прокладки. Внутренний стакан закройте крышкой с тремя отверстиями.
Взвесьте внутренний калориметрический стакан на весах и налейте в него 100 мл раствора щелочи; отметьте температуру раствора с точностью до 0,10С (tщ). Вставьте внутренний стакан с раствором щелочи во внешний стакан, закройте его крышкой. В отверстия крышки поместите мешалку, термометр, воронку. Отмерьте цилиндром 100 мл раствора кислоты и измерьте его температуру (tк).
При непрерывном помешивании быстро прилейте через воронку раствор кислоты к раствору щелочи. Отметьте самую высокую температуру раствора – tкон, которую показывает термометр после смешения растворов. Вычислите среднюю температуру растворов до реакции – tнач (среднее арифметическое из температур растворов кислот и щелочи), затем рассчитайте разницу
∆ t = tкон - tнач.
Вычислите теплоту q, выделяющуюся в калориметре, по формуле
q= ∆ t∙cm,
где cm- теплоемкость системы.
Теплоемкость системы
cm= с1m1+ c2m2,
где с1 – удельная теплоемкость стекла, которая равна 0,753 Дж/(г∙град); m1 – масса калориметрического стакана; с2 – удельная теплоемкость раствора, которую принимают равной 4,184 Дж/(г∙град); m2 – масса раствора.
Масса раствора
m2= Vkρk+Vщρщ,
где Vk – объем кислоты; ρk – плотность кислоты; Vщ – объем щелочи; ρщ – плотность щелочи.
Тепловой эффект реакции нейтрализации (Дж/моль) рассчитайте по формуле
∆Н=
![]() .
.
Определение проведите по 2 раза с сильными кислотами и щелочами и один раз со слабыми.
Результаты опытов запишите в таблицу.
|
Система |
m1, г |
m2, г |
tщ и tк |
tнач= (tщ+tк)/2 |
tкон |
∆ t |
q, кДж |
∆Н, кДж/моль |
|
I. NaOH, HCl |
|
|
|
|
|
|
|
|
|
II. KOH, HNO3 |
|
|
|
|
|
|
|
|
|
III.NH4OH, CH3COOH |
|
|
|
|
|
|
|
|
Сравните полученные данные ∆Н с истинным значением теплоты нейтрализации, равной 56,9 кДж/моль, найдите отклонения результатов от истинного значения теплоты нейтрализации сильной кислоты сильным основанием.
Опыт №2. Определение теплоты гидратации.
При растворении кристаллических солей в воде происходят два основных процесса: первый – эндотермический, связанный с разрушением кристаллической решетки; второй – экзотермический, обусловленный взаимодействием частиц растворяемого вещества с молекулами растворителя и образованием гидратированных частиц (ионов, молекул). В зависимости от того, какой из двух процессов преобладает, тепловой эффект растворения может быть положительным или отрицательным.
В предварительно взвешенный калориметрический стакан налейте 150 мл дистиллированной воды. Отвесьте 8 г безводного сульфата меди с точностью до 0,01 г. Отметьте с точностью до 0,10температуру воды в калориметре - tнач, затем при перемешивании внесите соль в воду и отметьте максимальную температуру - tкон.
Рассчитайте количество теплоты, выделяющееся в калориметре, по формуле
q= [с1mст+ c2 (mв + mс)]∆t,
где q – количество выделившейся теплоты, Дж; с1- удельная теплоемкость стекла [0,753 Дж/(г∙град)]; mст – масса калориметрического стакана, г; с2 – удельная теплоемкость раствора [4,184 Дж/(г∙град)]; mв – масса воды, г; mс - масса соли, г; ∆t – разность температур.
Рассчитайте тепловой эффект ∆Н по формуле
∆Н=![]()
где М – молярная масса безводной соли.
Теплота растворения CuSO4∙5H2O при 200С ∆Нр=11,5 кДж/моль.
Рассчитайте теплоту гидратации сульфата меди:
CuSO4(к) + 5H2O(ж)= CuSO4∙5H2O(к).
Согласно закону Гесса,
∆Нгидр= ∆Н- ∆Нр.
Полученные результаты занесите в таблицу.
|
mст, г |
mв, г |
mс, г |
tнач |
tкон |
∆t= tкон - tнач |
q, Дж |
∆Нгидр, кДж/моль |
|
|
|
|
|
|
|
|
|
-
ПРИМЕРЫ РАСЧЕТОВ
ПРИМЕР 1. По термохимическому уравнению рассчитать стандартную энтальпию образования продукта реакции:
2Fe3O4(T) + 9SO2(Г) + 5О2(Г) = 3Fe2(SO4)3(T), ∆Н0298(р)=-2845,7 кДж.
РЕШЕНИЕ. Согласно первому следствию из закона Гесса, стандартная энтальпия данной реакции
![]()
следовательно, стандартная энтальпия образования 3Fe2(SO4)3(Т)

ПРИМЕР 2. Рассчитайте тепловой эффект реакции горения сероводорода Н2S(г)+3/2O2 →H2O(ж) + SO2(г) по следующим данным:
1) S(к) + Н2 → Н2S(г), ∆Н1= -20,17 кДж,
2) Н2 + 1/2О2 →Н2О(ж), ∆Н2= -286,0 кДж,
3) S(к) + О2 → SО2(г), ∆Н3 = -297,0 кДж.
РЕШЕНИЕ. Уравнения 1-3 – это термохимические уравнения образования соответственно 1 моль Н2S(г), Н2О(ж), SО2(г) из простых веществ в стандартных условиях.
Если сложить термохимические уравнения 2 и 3 и вычесть уравнение 1, получим искомое уравнение
 +
Н2
+
1/2О2
→Н2О(ж), ∆Н1
+
Н2
+
1/2О2
→Н2О(ж), ∆Н1
+ S(к) + О2 → SО2(г), ∆Н2

 -
S(к)
+
Н2
→ Н2S(г), ∆Н3
-
S(к)
+
Н2
→ Н2S(г), ∆Н3
Н2S(г)+ 3/2O2 →H2O(ж) + SO2(г), ∆Н=∆Н1+∆Н2-∆Н3.
Подставив численное значение энтальпий образования Н2S(г), Н2О(ж), SО2(г), получим значение теплового эффекта реакции
∆Н= -286 – 297 – (- 20,17) = -562,8 кДж.
ПРИМЕР 3. С помощью термохимического уравнения Н2S(г)+3/2O2 →H2O(ж) + SO2(г) + 562,8 кДж определите объем сгоревшего сероводорода, если известно, что в результате реакции выделилось 281,4 кДж.
РЕШЕНИЕ. Проведем расчет по уравнению и определим объем сероводорода:
х л 281,4 кДж
Н2S(г)+3/2O2 →H2O(ж) + SO2(г) + 562,8 кДж
22,4 л
2
 2,4 562,8
кДж
2,4 562,8
кДж
х = 281,4 кДж ; х= V(Н2S) = 11,2 л.
ПРИМЕР 4. Рассчитайте стандартную энергию Гиббса реакции 2Н2S(г)+ 3O2 (г)→2H2O(ж) +2 SO2(г). Является ли эта реакция термодинамически возможной в закрытой системе?
РЕШЕНИЕ. Стандартную энергию Гиббса данной реакции рассчитывают по уравнению Гиббса-Гельмгольца
∆G0298(р) =∆H0298(р) – 298 ∆S0298(р),
где стандартная энтальпия реакции

Стандартная энтропия реакции
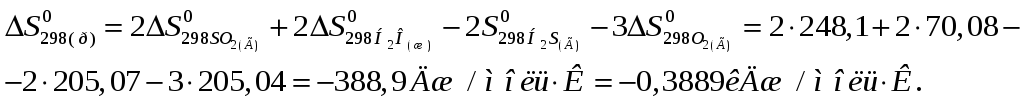
Подставляя числовые значения стандартных энтальпии и энтропии процесса в уравнение Гиббса-Гельмгольца, получаем
∆G0298(р)= -1123,46 – 298 (-0,3889) = -1007,6 кДж (∆G0298(р)<0),
Следовательно, данная реакция является термодинамически возможной в закрытой системе при стандартных условиях.
