
- •Химия свойства растворов
- •Темплан 2008 г., п. 104
- •Предисловие
- •Теоретическая часть
- •Понижение давления пара растворителя над раствором
- •Повышение температуры кипения раствора
- •Б. Свойства разбавленных растворов электролитов
- •1. Степень диссоциации и изотонический коэффициент
- •2. Константа диссоциации слабого электролита и ее связь со степенью диссоциации
- •3. Уравнения для количественного выражения свойств растворов электролитов
- •В. Растворы сильных электролитов
- •Примеры задач и их решения
- •III. Задачи для самостоятельной работы
- •Список рекомендуемой литературы
Примеры задач и их решения
Пример 1. При 25 °С осмотическое давление раствора, содержащего 2,8 г высокомолекулярного соединения (ВМС) в 200 мл раствора, равно 0,7 кПа. Найти молекулярную массу растворённого вещества.
Решение. Из формулы (1) следует, что
![]()
где R = 8,314 Дж/(моль∙К), а Т = t + 273 ° = 25 °+ 273 °= 298 К. Подставим в это уравнение данные из условия
![]()
приведем единицы измерений в соответствие и определим молекулярную массу ВМС
![]()
отсюда молекулярная масса ВМС равна 4,95-104 у.е.
Ответ: 4,95-104.
Пример 2. В 1 мл раствора содержится 1018 молекул неэлектролита. Вычислить осмотическое давление этого раствора при 25 °С в атмосферах.
Решение.
Поскольку
1 мл раствора содержит 1018
молекул неэлектролита, то в 1
л его находится
![]() молекул этого вещества.Следовательно,
молярная концентрация данного раствора
равна
молекул этого вещества.Следовательно,
молярная концентрация данного раствора
равна
![]()
По уравнению (1) вычислим осмотическое давление предложенного раствора
π = СМRT =1,66 ∙10-3∙0,082∙298 = 0,041 атм.
R=0,082 л∙атм/моль∙град и T= t+2730=250+2730=298K.
Ответ: 0,041 атм.
Пример 3. Кажущаяся степень диссоциации хлорида цинка ZnCl2 в 0,1 н растворе равна 0,85. Чему равно осмотическое давление этого раствора при 17°С в мм.рт.ст., атм., кПа?
Решение.
ZnCl2
-
сильный электролит, при растворении в
воде полностью диссоциирует ZnCl![]() →
Zn2+
+ 2Сl-.
Поскольку молекула ZnCl2
распадается на
три иона, то n
= 3.
→
Zn2+
+ 2Сl-.
Поскольку молекула ZnCl2
распадается на
три иона, то n
= 3.
Осмотическое давление этого раствора определим по формуле (10): π = i СМRT
Молярность раствора вычислим по формуле См ∙ М = Сн ∙Э или
![]() но
так как для хлорида цинка М = 2Э, тогда
но
так как для хлорида цинка М = 2Э, тогда
![]()
Изотонический коэффициент рассчитаем по уравнению (6):
i= α' (n-1) +1 =0,85(3-1)+ 1 =2,7.
R = 62,36 л ∙мм рт.ст/ (моль∙град),
Т = t +273° = 17° + 273° = 290 К.
Тогда π =2,7∙0,05∙62,36∙290= 2441,1 мм. рт. ст.= 3,21 атм. = 325,5кПа.
Ответы: 2441,1 мм. рт. ст., 3,21 атм., 325,5кПа.
Пример 4. Чему равно давление насыщенного пара над 10%-ным раствором карбамида СО(NН2)2 при 100 0С?
Решение. В 100 г 10 %-го раствора содержится 10г карбамида и 90г воды. Далее в решении используем уравнение (2), т.е.
![]() ,
тогда
Р°- Р = Р°- NB
и далее
,
тогда
Р°- Р = Р°- NB
и далее
Р = Р°- Р°∙ NB = P°(1-NB).
Из этого соотношения и уравнения (2) для нашего расчёта выводим формулу:

где Р° = 101,32 кПа - давление насыщенного пара над водой при 100°С [5, табл. 16];
m![]() =
10 г;М
=
10 г;М![]() =
60 г/моль;m
=
60 г/моль;m![]() =
90 г/моль;М
=
90 г/моль;М![]() =
18 г/моль,
=
18 г/моль,
тогда
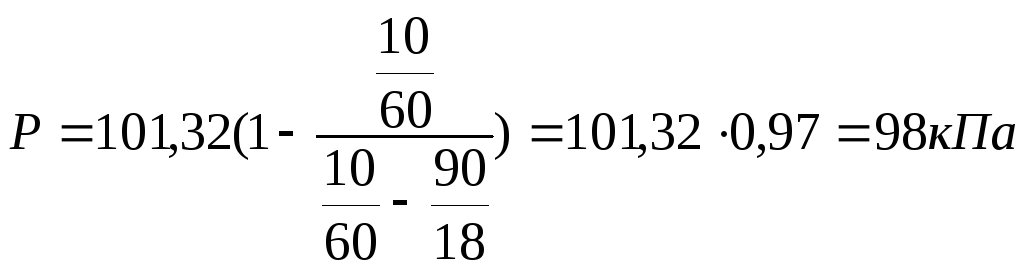 .
.
Ответ: 98 кПа.
Пример 5. При 100 °С давление пара раствора, содержащего 0,05 моль сульфата натрия Na2SO4 в 450 г воды, равно 100,8 кПа. Определить кажущуюся степень диссоциации Na2SO4 в этом растворе.
Решение. Кажущуюся степень диссоциации соли в этом растворе найдем по уравнению (7), т.е.
![]()
Изотонический коэффициент i найдем по уравнению
![]() ,
,
![]() Р
по условию равно 100,8 кПа, а
Р°
возьмём из [5,табл.16,],
Р
по условию равно 100,8 кПа, а
Р°
возьмём из [5,табл.16,],
тогда ∆Роп = 101,32 - 100,8 = 0,52кПа.
∆Рвыч
рассчитаем по уравнению (2):
![]() ,
,
где nв=0,05 моль Na2SO4, а nр-ля=450/18=25 моль Н2О, тогда
![]() и
и
![]() .
.
При диссоциации соли Na2SO4=2Na++SO42- молекула Na2SO4 распадается на три иона, поэтому n=3.
Подставляя найденные значения i и n в уравнение (7), определим
кажущуюся степень диссоциации Na2SO4:
![]() .
.
Ответ: 0,8 (80 %) .
Пример 6. При какой приблизительно температуре будет кипеть 50 %-й (по массе) раствор сахарозы C11H22O11?
Решение. Температуру кипения этого раствора определим по формуле ∆tk=tk р-ра- tk р-ля или tk р-ра= tk р-ля+∆t,
где - tk р-ля (Н2О)=1000С. Поскольку C11H22O11- неэлектролит, то ∆tk найдем по формуле (3), т.е.
![]()
где
растворителем является вода, а Е![]() = 0,52°; раствор 50 %-й -это значит, что в 100
г его содержится 50 г сахарозы и 50 г воды,
т.е.
= 0,52°; раствор 50 %-й -это значит, что в 100
г его содержится 50 г сахарозы и 50 г воды,
т.е.
mв = 50 г и mр-ля= 50 г; Мв= 342 г/моль - молярная масса сахарозы,
тогда
![]() иtk
р-ра=
1000
+ 1,520=101,520С.
иtk
р-ра=
1000
+ 1,520=101,520С.
Ответ:
101,52![]() С.
С.
Пример 7. При какой температуре закипит 2,12М водный раствор СаСl2? Плотность этого раствора равна 1,177г/мл. Кажущуюся степень диссоциации соли в этом растворе принять равной 90%.
Решение. Температуру кипения 2,12М раствора СаСl2 определим по формуле ∆tk=tk р-ра- tk р-ля или tk р-ра= tk р-ля+∆t,
где - tk р-ля (Н2О)=1000С.
СаСl2
-
электролит, поэтому ∆tk
раствора вычислим по уравнению (2):
![]()
Для расчета изотонического коэффициента i используем уравнение i=α/(n-1)+1.
Хлорид кальция в воде полностью диссоциирует.
СаСl2 = Са2+ + 2Сl-, т.е. из одной молекулы СаСl2 образуются один ион Са2+ и два иона 2Сl-, поэтому n=1+2=3,
тогда i=0,9∙(3-1)+1=2,8
Е
= Е![]() -
эбуллиоскопическая константа воды [5
табл.5].
-
эбуллиоскопическая константа воды [5
табл.5].
Мв =МСаСl2=111 г/моль молярная масса хлорида кальция.
Мв и mр-ля найдём, используя приведенные в условии примера См = 2,12 моль/л и плотность раствора, равную 1,177 г/мл. Сначала определим массу 1 л этого раствора
mр-ра=ρ∙Vр-ра= 1,177г/мл ∙ 1000мл = 1177 г .
mв-ва=m![]() =M
=M![]() ∙n
∙n![]() =111∙2,12=235,32
г,
=111∙2,12=235,32
г,
где
n![]() =2,12
- количество молей СаСl2
в 1 л растворе.
=2,12
- количество молей СаСl2
в 1 л растворе.
mр-ля=
m![]() =mр-ра-m
=mр-ра-m![]() =1177-235,32=941,68г.
=1177-235,32=941,68г.
Тогда
![]() и
и![]() =103,3°C
=103,3°C
Ответ:
103,3![]() С.
С.
Пример 8. В каком массовом отношении нужно смешать этиленгликоль (двухатомный спирт) С2Н6О2 с водой, чтобы получился антифриз (жидкость, замерзающая при низких температурах), замерзающий при - 30 °С?
Решение. Из формулы (4) следует
![]()
где
![]() ;
;
Мспирта= 62 г/моль - молярная масса этиленгликодя;
К = 1,86 °- криоскопическая константа воды [5],
тогда
![]()
т.е., например, антифриз, изготовленный из 10 кг воды и 10 кг этиленгликоля, замерзнет при - 30 °С.
Ответ:
![]()
Пример 9. 10 %-й раствор A12(SO4)3 замерзает при - 2,7 °С. Определить кажущуюся степень диссоциации этой соли в предложенном растворе.
Решение.
Используем формулу (7), т.е.
![]() .
.
Из
уравнения (13) имеем
![]()
где
![]()
Мв=342 г/моль - молярная масса Al2(SO4)3;
К- криоскопическая константа воды [5];
по условию задачи имеем 10%-й раствор Al2(SO4)3 - это значит, что mв=10г сульфата алюминия и mр-ля=90г воды, тогда
![]()
Al2(SO4)3 - сильный электролит, при его диссоциации
Al2(SO4)3= 2Al3++3SO42- из одной молекулы соли образуется 2 катиона Al3++ и 3 аниона SO42-, т.е. n=2+3=5.
И
наконец,
![]() (87%).
(87%).
Ответ: 0,87 (87%).
Пример 10. рН 0,01 М раствора муравьиной кислоты НСООН равен 2,88. Вычислить степень и константу диссоциации кислоты в этом растворе.
Решение. Степень диссоциации НСООН в 0,01 М растворе определим по уравнению (8), т.е.
![]()
НСООН - электролит слабый, поэтому диссоциирует частично и обратимо по уравнению
НСООН↔НСОО- +Н+.
Константа её диссоциации КД выражается отношением
![]() ,
,
а
так как из уравнения (5) следует, что
![]() и
и
![]() ,
тогда
,
тогда
![]() ,
,
но
![]() и
и![]() (электролит
слабый), отсюда
(электролит
слабый), отсюда![]()
![]() найдем
по уравнению
найдем
по уравнению
![]() или
или![]() и тогда
и тогда![]() ,
,
![]() и
и
![]()
Ответ: 0,132; 1,74∙10-4.
