
- •Введение
- •1. Строение атома и периодическая система элементов д.И. Менделеева
- •1.1. Строение атома
- •1.2. Квантово - механическое объяснение строения атома
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева и электронная структура атомов
- •1.5. Свойства элементов и периодическая система
- •Вопросы для самоконтроля
- •2. Строение молекул и химическая связь
- •2.1. Ковалентная связь. Метод валентных связей
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ковалентные связи с участием атома углерода
- •2.4. Ионная химическая связь
- •2.5. Металлическая связь
- •2.6. Водородная связь
- •2.7. Поляризация связи и дипольный момент
- •2.8. Основные параметры молекул
- •2.9. Метод молекулярных орбиталей
- •3. Индивидуальные задания для самостоятельной подготовки студентов
- •3.1. Примеры решения типовых задач
- •3.2. Варианты домашних заданий
- •Оглавление
Вопросы для самоконтроля
Исходя из строения атомов, объясните, как и почему изменяются химические свойства элементов 4 – го периода. Приведите примеры электронных формул s -, p – и d – элементов этого периода.
Приведите схемы распределения электронов по энергетическим уровням и подуровням для атомов хлора и марганца, а также ионов Cl- и Mn2+.
Приведите электронные формулы, охарактеризуйте химические свойства, определите, какую высшую валентность и почему могут проявлять элементы с порядковыми номерами 25 и 53.
Л И Т Е Р А Т У Р А
Глинка, Н.Л. Общая химия: учеб. / Н.Л. Глинка. – М.: Интеграл - Пресс, 2002. Гл. 2 (§2.1 – 2.6); Гл. 3 (§ 3.1 –3.4).
Глинка, Н.Л. Задачи и упражнения по общей химии. / Н.Л. Глинка. – М.: Интеграл - Пресс, 2001. Гл. III (§1).
Коровин, Н.В. Общая химия: учеб. / Н.В.Коровин. – М.: Высшая школа, 2002. Гл 1.
2. Строение молекул и химическая связь
Учение о строении вещества объясняет причины многообразия химических соединений и их состав, строение молекул и структуры веществ в различных агрегатных состояниях. Совокупность химически связанных атомов представляет собой сложную систему атомных ядер и электронов. В образовании химической связи существенны только электростатические силы, т.е. силы взаимодействия электрических зарядов, носителями которых являются электроны и ядра атома. Так как при химических реакциях заряд ядра и внутренние электронные уровни атомов не изменяются, то химическая связь осуществляется в основном так называемыми валентными электронами, находящимися на внешних электронных уровнях (или на внутренних незавершенных d и f – подуровнях), взаимодействующих атомов с ядрами этих атомов.
В зависимости от характера распределения валентных электронов в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую.
Для объяснения химической связи в молекулах в настоящее время наиболее широкое распространение получили два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО). Оба метода позволяют трактовать процесс формирования химической связи и определять внутреннее строение вещества.
2.1. Ковалентная связь. Метод валентных связей
Основные положения метода валентных связей:
химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар (обобществления двух электронов);
энергия обмена электронами между атомами (в результате перекрывания орбиталей) вносит основной вклад в энергию химической связи;
в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами;
характеристики химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО.
Квантово - механические представления о строении электронных оболочек позволяют качественно объяснить и количественно рассчитать в соответствии с современным уровнем развития квантовой химии образование ковалентной связи.
Рассмотрим образование молекулы Н2 из 2-х атомов водорода:
Н(Г) + Н(Г) = Н2.
По методу валентных связей при сближении двух атомов водорода происходит перекрывание их s- орбиталей, каждая из которых содержит один электрон. Этот процесс сопровождается выделением энергии при образовании общей электронной пары.
Как показывает квантово - механический расчет молекулы водорода, проведенный немецкими учеными В. Гейтлером и Ф. Лондоном, по мере сближения атомов водорода, электроны которых имеют антипараллельные спины, вначале преобладают силы притяжения между ядром одного атома и электроном другого, а в дальнейшем - силы отталкивания между ядрами и электронами разных атомов (рис. 4, кривая 1). В результате сначала имеет место понижение энергии двух атомов. Затем, когда силы отталкивания и притяжения выравниваются, достигается состояние минимума потенциальной энергии, отвечающего 432,1 кДж/моль и межъядерному расстоянию ro = 0,074 нм. Далее происходит резкое увеличение энергии вследствие возрастания отталкивания между двумя ядрами. Именно минимум на кривой энергии отвечает наиболее устойчивому состоянию системы двух атомов – состоянию образования химической связи и возникновению молекулы Н2.
Возникновение молекулы Н2 из атомов обязано перекрыванию атомных электронных облаков с образованием молекулярного двухэлектронного облака, которое окружает два положительно заряженных ядра. В месте перекрывания облаков, т.е. в пространства между ядрами, электронная плотность связывающего облака оказывается максимальной.

Рис. 4. Зависимость потенциальной энергии системы (Е) из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами в зависимости от расстояния между ядрами
При сближении же атомов водорода, у которых спины электронов параллельны (рис. 4, кривая 2), при всех значениях r преобладают силы отталкивания, т.е. потенциальная энергия все время растет с уменьшением r, и связь не возникает.
Таким образом, условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов.
Чем прочнее химическая связь, тем больше энергии нужно затратить для ее разрыва. Поэтому энергия разрыва связи служит мерой ее прочности.
Ковалентная связь может быть образована атомами одного и того же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру и тогда она полярная; например Н2О, NF3 и др.
Особенностями ковалентной химической связи являются ее насыщаемость и пространственная направленность.
Насыщаемость ковалентной связи обусловлена ограничением числа валентных электронов, находящихся на внешних оболочках, участвующих в образовании ковалентной связи.
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью.
В представлении метода валентных связей численное значение валентности данного атома соответствует числу ковалентных связей, которые он образует.
Поскольку пребывание двух электронов с противоположными спинами в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле действия своего ядра, в образовании ковалентных связей принимают участие все имеющиеся одноэлектронные облака.
Количественной мерой валентности в рамках метода валентных связей считают число неспаренных электронов у атома в основном или возбужденном состояниях. Это неспаренные электроны внешних оболочек у s – и p – элементов, внешних и предвнешних оболочек у d – элементов.
Например, электронное строение атома кислорода (1s22s22p4) выражается следующим распределением электронов по квантовым ячейкам Гунда:
|
|
|
↑↓ |
↑ |
↑ |
|
2 |
↑↓ |
|
p |
|
|
1 |
↑↓ |
|
|
|
|
|
s |
|
|
|
В атоме имеется два неспаренных электрона, поэтому его валентность равна двум.
В ряде случаев число неспаренных электронов увеличивается в результате возбуждения атома вследствие небольшого энергетического воздействия, при котором двухэлектронные облака распадаются на одноэлектронные.
Возбуждение атомов требует затраты энергии, поэтому распаривание электронов возможно лишь в тех случаях, когда затрата энергии компенсируется энергией, выделяемой при образовании дополнительных связей.
Например, атом бериллия Ве имеет электронное строение1s22s2, которое представлено следующим распределением электронов по квантовым ячейкам:
-
↑
2
↓↑
p
2
↑
p
Ве
1
↓↑

Be*
1
↓↑
s
s
Однако атом бериллия может проявлять валентность, равную двум, за счет перехода одного из 2s –электронов в свободную 2р ячейку Гунда, что приводит к увеличению числа неспаренных электронов.
Следует иметь в виду, что такое распаривание электронов происходит в пределах данного энергетического уровня, так как для перехода электронов на новый энергетический уровень необходима значительно бóльшая энергия.
Аналогичным образом можно определить, что для атома фосфора валентности составляют 3 и 5, атома серы – 2, 4 и 6, а для атома хлора – 1, 3, 5, 7.
Направленность ковалентной связи. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи.
В
зависимости
от способа перекрывания и симметрии
образующегося облака различают
![]() (сигма)
– и
(сигма)
– и![]() (пи)
–связи.
(пи)
–связи.
Связь, образованная электронами, орбитали которых дают наибольшее перекрывание по линии, соединяющей центры атомов, называется сигма – связью (рис. 5.) .
Связь,
образованная электронами, орбитали
которых дают наибольшее перекрывание
по обе стороны от линии, соединяющей
центры атомов, называется
![]() -
связью (рис.
5).
-
связью (рис.
5).

Рис. 5. Схема перекрывания орбиталей при образовании
![]() и
и
![]() -связей
в молеуле N2
-связей
в молеуле N2
В
молекуле азота N
≡ N
тройная
связь между атомами азота реализуется
за счет одной
![]() связи
- и двух
связи
- и двух
![]() -
связей.
-
связей.
Пространственная конфигурация молекул определяется числом атомов в молекуле и числом электронных пар связей за счет неподеленных электронов.
Поскольку электронные облака (кроме s –облака) направлены в пространстве, то химические связи, образуемые с их участием, пространственно направлены. Гантелевидные р – орбитали расположены в атоме взаимно перпендикулярно. Следовательно, угол между связями р – электронов атома, должен быть равен 90о. Таким образом, пространственное расположение сигма-связей определяет пространственную конфигурацию молекул.
Химическая связь в молекуле H2S образуется из атома серы и двух атомов водорода. Атом серы (S ….3s23p4) имеет два неспаренных р – электрона, которые занимают орбитали, расположенные под углом 90о друг к другу. Атомы водорода имеют по 1 s – электрону. При сближении одного из атомов водорода с 1s –электроном, спин которого направлен противоположно спину одного из неспаренных 2р –электронов атома серы, образуется общее электронное облако, связывающее атомы серы и водорода. При этом угол между связями в молекуле H2S должен быть близок к углу между облаками р –электронов, т.е. к 90о. Аналогичную пространственную структуру имеют молекулы H2Se и H2Te.
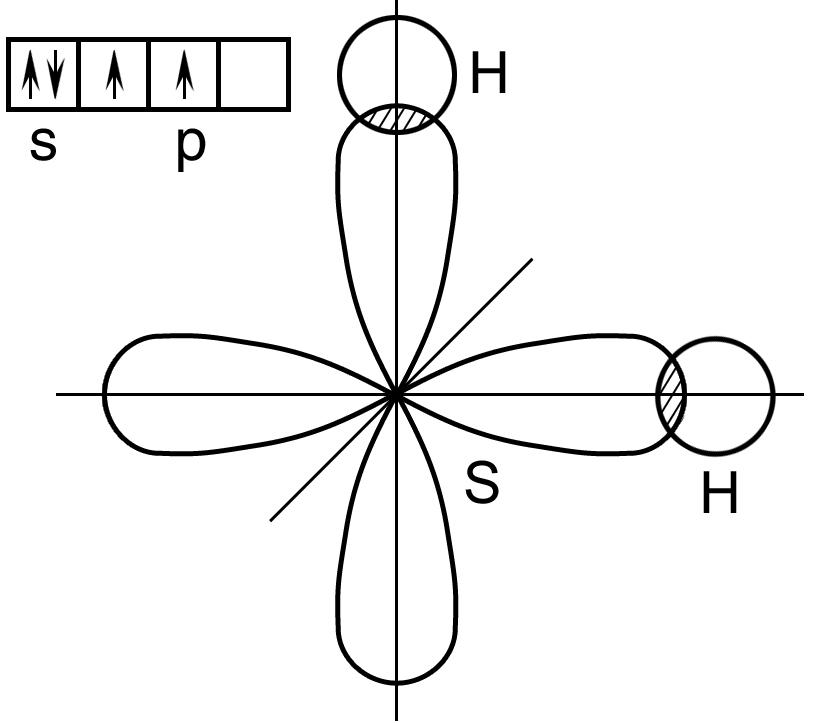
Рис. 6. Пространственная конфигурация молекулы H2S
Атом
фосфора имеет три неспаренных р
–электрона,
орбитали
которых расположены в
трех взаимно перпендикулярных
направлениях. Очевидно, в соответствии
с требованиями метода валентных связей
три
![]() - связи в молекуле РН3
должны расположиться под углами одна
к другой, близкими к 90° (рис. 7).
- связи в молекуле РН3
должны расположиться под углами одна
к другой, близкими к 90° (рис. 7).
Аналогичное строение имеют молекулы AsH3 и SbH3, углы между связями также близки к 90о.

Рис. 7. Пространственная конфигурация молекулы РН3
Донорно
- акцепторный механизм образования
ковалентной связи.
Ковалентная связь может образоваться
не только за счет перекрывания
одноэлектронных облаков, но и за счет
двухэлектронного
облака одного атома (донора)
и свободной орбитали другого атома
(акцептора).
Например,
в молекуле аммиака (NH3)
азот имеет неподеленную пару электронов,
а у катиона водорода (Н+)
s-орбиталь
свободна:
![]()
![]()
![]() □
□![]()
![]()
![]() .
.

Рис. 8. Образование иона аммония
При достаточном сближении молекулы аммиака и катиона водорода возникает ковалентная связь с образованием катиона аммония [NH4]+ (рис.8).
Следует подчеркнуть, что в образовавшемся катионе аммония все четыре связи N-H равноценны, не различимы, и не зависят от первоначального происхождения.
