
- •Введение
- •1. Строение атома и периодическая система элементов д.И. Менделеева
- •1.1. Строение атома
- •1.2. Квантово - механическое объяснение строения атома
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева и электронная структура атомов
- •1.5. Свойства элементов и периодическая система
- •Вопросы для самоконтроля
- •2. Строение молекул и химическая связь
- •2.1. Ковалентная связь. Метод валентных связей
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ковалентные связи с участием атома углерода
- •2.4. Ионная химическая связь
- •2.5. Металлическая связь
- •2.6. Водородная связь
- •2.7. Поляризация связи и дипольный момент
- •2.8. Основные параметры молекул
- •2.9. Метод молекулярных орбиталей
- •3. Индивидуальные задания для самостоятельной подготовки студентов
- •3.1. Примеры решения типовых задач
- •3.2. Варианты домашних заданий
- •Оглавление
2.6. Водородная связь
Водородная связь – особый тип межмолекулярного взаимодействия. Атомы водорода, которые ковалентно связаны с атомом элемента, имеющего высокое значение электроотрицательности (чаще всего F, O, N, а также Cl, S и C), несут на себе относительно высокий эффективный заряд. Вследствие этого такие атомы водорода могут электростатически взаимодействовать с атомами указанных элементов. Так, атом Н+ одной молекулы воды ориентируется и соответственно взамодействует (что показано тремя точками) с атомом О- другой молекулы воды:
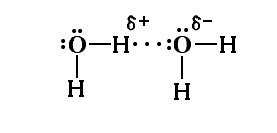
В твердой воде (лед) каждый атом О тетраэдрически окружен четырьмя атомами Н (два их них связаны ковалентно, два других – электростатически); получается соответствующая кристаллическая решетка льда. В жидкой воде практически отсутствуют свободные молекулы Н2О, которые за счет электростатического взаимодействия указанного типа объединяются в агрегаты.
Связи, образуемые атомом Н, находящимся между двумя атомами электроотрицательных элементов, называются водородными:
- + -
А - Н В
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (150 – 400 кДж/моль). Для соединений фтора она достигает порядка 40 кДж/моль. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул соответствующих соединений в жидком состоянии, например, в жидком фтороводороде НF (рис. 26).

Рис. 26. Агрегация молекул НF за счет водородных связей
Длина водородной связи также меньше длины ковалентной связи. Так в полимере (HF)n длина связи F - H = 0,092 нм, а связи F∙∙∙H = 0,14 нм. У воды длина связи O - H = 0,096 нм, а связи O ∙∙∙ H = 0,177нм.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления.
2.7. Поляризация связи и дипольный момент
Электронная плотность в молекулах распределяется в зависимости от электроотрицательности (ЭО) атомов, образующих молекулу. Симметричное расположение зоны повышенной электронной плотности можно объяснить тем, что одинаковые атомы в молекуле, обладающие одной и той же электроотрицательностью, в равной степени действуют на электронную плотность и она располагается симметрично относительно ядер двух атомов. Атомы, имеющие разные значения электроотрицательности, различно влияют на электронную плотность, и при этом она смещается из симметричного положения ближе к тому атому, у которого ЭО больше.
Смещение электронной плотности к атому с большей ЭО получило название поляризации.
Молекулы, образованные атомами, имеющими одинаковую ЭО, являются электросимметричными, т.е. у них “центры тяжестей” положительных и отрицательных зарядов совпадают. Такие молекулы получили название ковалентных неполярных (например, H2, Cl2) , а связь в них называется ковалентной неполярной связью.
Молекулы, в которых имеет место поляризация, характеризуются электрической асимметрией, у таких молекул “центры тяжести” положительных и отрицательных зарядов не совпадают.
По
этой причине распределение электронной
плотности вдоль связи асимметрично, а
следовательно, атом более электроотрицательного
элемента приобретает отрицательный
эффективный заряд
(обозначение
![]() ),
а атом-партнер –положительный
эффективный заряд (обозначение
),
а атом-партнер –положительный
эффективный заряд (обозначение
![]() ).
).
Ковалентные связи между атомами, несущими некоторый эффективный заряд, называются полярными ковалентными связями, а молекулы - ковалентно-полярными.
Пример.
В молекуле HCl
распределение электронной плотности
вдоль связи H
– Cl
таково, что электрический “центр
тяжести” отрицательного заряда смещен
к атому Cl,
а “центр тяжести” положительного
заряда – к атому Н. В результате на
атомах хлора и водорода возникают
эффективные заряды Н![]() -
Cl
-
Cl![]() .
.
Полярные молекулы являются диполями, т.е. системами, состоящими из двух равных по величине и противоположных по знаку зарядов, находящихся на некотором расстоянии один от другого. Полярной является молекула воды Н2О.
Расстояние
между центрами положительного и
отрицательного зарядов называется
длиной
диполя
![]() .
Полярность молекулы характерзуется
величиной ее дипольного
момента
.
Полярность молекулы характерзуется
величиной ее дипольного
момента
![]() ,который
равен векторной сумме дипольных моментов
связей, имеющихся в молекуле.
Дипольный момент связи равен произведение
длины диполя
,который
равен векторной сумме дипольных моментов
связей, имеющихся в молекуле.
Дипольный момент связи равен произведение
длины диполя
![]() на величину электрического заряда
на величину электрического заряда
![]() :
:
![]() .
.![]()
Длина диполя имеет значение порядка диаметра атома, т.е. 10-8см, а величина заряда электрона 1,6 • 10-19Кл. Дипольный момент выражают в дебаях и обозначают буквой D. В системе единиц СИ дипольный момент измеряется в кулон - метрах (Кл∙м):
1D = 3,3∙10-30 Кл·м.
Например, в ряду галогеноводородов с уменьшением разности ЭО атомов, образующих молекулу, дипольный момент убывает:
-



HCl
HBr
HI
 =
1,04
=
1,04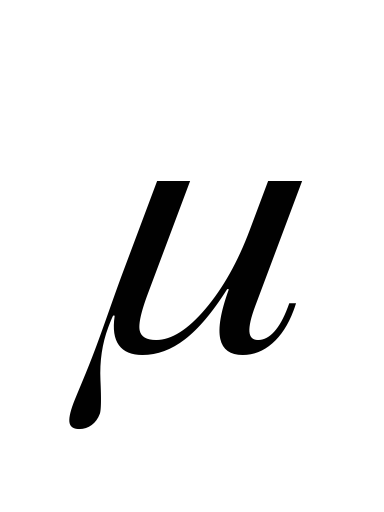 =0,79
=0,79 =0,39
=0,39
Дипольный момент двухатомных молекул равен дипольному моменту связи. Если связь неполярная, то и молекула неполярна.
В многоатомных молекулах дипольный момент молекулы равен векторной сумме дипольных моментов отдельных связей. Например, молекула СО2(О-= С+= О-) - неполярна, хотя связи С = О полярны, так как О ← С → О и суммарный дипольный момент молекулы равен нулю.
Молекула SO2полярна,
дипольный момент![]() =
1,61D.
=
1,61D.
Полярность молекулы зависит не только от наличия в ней полярных связей, но и от геометрической формы молекулы. В рассмотренных примерах молекула СО2имеет линейное строение, а молекулаSO2– угловое строение.
