
- •Основы химической термодинамики
- •Некоторые основные термины и определения
- •Понятие о функции состояния
- •Внутренняя энергия, теплота, работа
- •Первый закон термодинамики. Понятие об энтальпии
- •Тепловой эффект химической реакции
- •Термохимические расчеты
- •Понятие об энтропии и второй закон термодинамики
- •Число микросостояний (термодинамическая вероятность) и энтропия
- •Свойства энтропии Зависимость энтропии от объема
- •Зависимость энтропии от давления
- •Зависимость энтропии от температуры
- •Энергия Гиббса и состояние химического равновесия
- •Химическое равновесие
- •Вопросы для подготовки к семинару и экзамену
- •Примеры решения задач
- •2 Моля so3 - 198 кДж
- •Задачи для домашних заданий
- •Варианты домашних заданий
- •Задача повышенной трудности.
- •Приложение
- •Фундаментальные физические константы
- •Нуль шкалы Цельсия То 273,15 к
Вопросы для подготовки к семинару и экзамену
1. Статистические характеристики систем, состоящих из большого числа частиц. Понятие о функции состояния системы и основные свойства таких функций.
2. Первый закон термодинамики. Изобарные и изохорные процессы: внутренняя энергия и энтальпия как функция состояния системы. Стандартное состояние и стандартные значения энергии и энтальпии.
3. Стандартная энтальпия образования вещества. Зависимость энтальпии простого вещества от температуры и агрегатного состояния.
4. Расчет тепловых эффектов химических реакций. Законы Гесса и Лавуазье-Лапласа.
5. Термодинамическая вероятность как мера беспорядка в системе. Уравнение Больцмана. Энтропия как функция состояния системы и характер ее изменения при изменении основных параметров системы (агрегатное состояние, концентрация, объем, давление, температура).
6. Энергия Гиббса. Второй закон термодинамики: направление процесса и критерий равновесия системы. Связь константы химического равновесия с изменением энергии Гиббса. Влияние температуры на направление процесса.
Примеры решения задач
Пример
1.
При сгорании 1 кг метана выделилось
50137,5 кДж теплоты. Рассчитать стандартную
энтальпию образования метана DНоСН4.
![]()
Решение.
1. Переведем количество участвующего в реакции метана, выраженное в граммах, в моли (учитывая, что молярная масса СН4 равна 16 г/моль):
Количество СН4 в молях n СН4 равно:
n
СН4=
![]() = 62,5 моль.
= 62,5 моль.
2. Рассчитаем количество теплоты, выделяющееся при сгорании 1 моля метана:
![]()
3. Запишем термохимическое уравнение реакции горения метана:
CH4(г)+ 2О2(г) = CО2(г) + 2Н2О(г) , QР = 802,2 кДж,
DНор = - QР.
DНореакции = (DНоСО2+ 2 DНоН2О ) - (DНоСН4+ 2 DНоО2) =
= [(-393,5) + 2(-241,8) - (DНоСН4) - 2(0)] кДж = - 802,2 кДж.
Отсюда: DНоСН4= (802,2 - 393,5 - 483,6) = - 74,9 кДж/моль СН4.
Пример 2. Рассчитать количество теплоты, которое выделится при полном сгорании 100 л этана, взятого в газообразном состоянии при н.у., если в результате реакции образуется СО2(Г) и Н2О(Г).
Решение.
1. Реакция горения этана выражается термохимическим уравнением:
С2Н6(г) + З,5O2(г) = 2CO2(г) + 3Н2О(г); Нр = -1559,87 кДж.
2. Переведем количество участвующего в реакции этана, выраженное в литрах (н.у.), в моли (учитывая, что 1 моль газа при н.у. занимает объем, равный 22,4 л):
Количество
этана в молях
![]() равно:
равно:
![]() =
=![]() =
4,46 моль.
=
4,46 моль.
3.
Находим значения стандартных энтальпий
образования (![]() Но298)
для всех веществ, участвующих в реакции
(см. Приложение, табл. 2,3) и рассчитываем
тепловой эффект в расчете на один моль
С2Н6(Г):
Но298)
для всех веществ, участвующих в реакции
(см. Приложение, табл. 2,3) и рассчитываем
тепловой эффект в расчете на один моль
С2Н6(Г):
![]() Нореакции
=
Нореакции
=
![]() =
[2(-393,5) + 3(-241,8)] – [-84,7 + 3,50]
= - 1427,7 кДж/моль С2Н6(Г).
=
[2(-393,5) + 3(-241,8)] – [-84,7 + 3,50]
= - 1427,7 кДж/моль С2Н6(Г).
QP
= -![]() Нореакции
= 1427,7 кДж.
Нореакции
= 1427,7 кДж.
4. Пересчитаем полученный тепловой эффект на реальное количество этана, т.е. на 4,46 моля (100 л, н.у.):
QP=
-![]() Нореальн.= 1427,74,46 = 5767,42 кДж
Нореальн.= 1427,74,46 = 5767,42 кДж
Пример 3. Не производя вычислений, определить знак изменения энтропии в следующих реакциях. Рассчитать изменение энтропии для стандартных условий и сравнить с результатом оценки.
2NН3(г) = N2(г) + 3H2(г) (1) NH4NO3(тв) = N2O(г) + 2Н2О(г) (2)
2Н2(г) + O2(г) = 2Н2O(г) (3)
2Н2(г) + O2(г) = 2Н2O(ж) (4)
Решение. В первой реакции из 2-х молей вещества, находящегося в газообразном состоянии образуется 4 моля веществ, находящихся в газообразном состоянии, следовательно, DS1 0. Изменение энтропии этой реакции в стандартных условиях (DSо298) равно:
DSо298= SоN2 (Г)+ 3SоН2(г) - 2SоNН3(г) =191,5+ 3130,5 -2192,7=197,6 Дж/К.
Во второй реакции 1 моль вещества в твердом состоянии образует 3 моля газообразных веществ, следовательно, DS20. Изменение энтропии этой реакции в стандартных условиях (DSо298) равно:
DSо298=SоN2О(г)+2SоН2О(г)–SоNН4NO3(тв)=219,8 + 2188,7–151= 446,2 Дж/К.
В (3) и (4) реакциях уменьшается как общее число молей, так и число молей газообразных веществ, так что DS30 и S4 0, при этом S4 имеет более отрицательное значение, т.е. больше по абсолютной величине чем S3, так как SН2О(г) SН2О(ж).
Пример 4. Установить возможность восстановления диоксида титана до свободного металла по следующей реакции при стандартных условиях и при 2500К (зависимостью DHор и Sор от температуры пренебречь):
TiO2(тв) + 2С(тв) = Ti(тв) + 2СО(г).
Решение.Из второго закона термодинамики следует, что самопроизвольно протекают только такие реакции, которые сопровождаются уменьшением энергии Гиббса (DGр 0).
1. Рассчитаем DGор для стандартных условий с учетом данных приложения (табл. 2):
DGорекции = DGопродуктов – DGоисходных веществ
DGор = (2DGоСО(г) + DGоTi(тв)) – (DGoTiO2(тв) + 2DGoС(тв)) =
= [2(- 137,1) + 0] – [(- 888,6) – 2 0] = 614,4 кДж.
Поскольку DGор 0, реакция при 298 К невозможна.
2. Рассчитаем изменение энергии Гиббса этой реакции для 2500 К, для чего воспользуемся уравнением:
DGр= DHоp - TDSоp.
Находим изменение энтальпии реакции при стандартных условиях DHор :
DHоpеакции = (2DHоСО(г) + DНоTi(тв)) – (DНоTiO2(тв) + 2DНоС(тв)) =
= [2(- 110,5) + 0] – [(- 943,9 ) –2 0 ] = 722,9 кДж = 722900 Дж.
Аналогично вычисляем DSоp:
DSоpеакции = (2SоСО(г) + SоTi(тв)) – (SоTiO2(тв) + 2SоС(тв)) =
= [ 2 197,5 + 30,6] – [50,3 –2 5,7 ] = 363,9 Дж/К.
DG2500 = DHор - TDSор = 722900 – 2500 363,9 = -186850 Дж.
DG2500 = -186,85 кДж.
Поскольку DG2500 0, то реакция при 2500 К возможна.
Пример 5. Определить константу равновесия реакции поглощения углекислого газа негашеной известью при температуре 227 оС и давлении 1 атм.
Решение:
1.Запишем уравнение реакции:
СаО(тв) +СО2(г) = СаСО3(тв).
2.Определим изменение энтальпии для этой реакции:
DHoр = DHoСаСО3(тв)- DHoСаО(тв) +DHoСО2(г) =
=1208,5 - (636,4) - (-393,5) = -178,6 кДж/моль.
3.Определим изменение энтропии:
DSoр = DSoСаСО3(тв)- DSoСаО(тв) +DSoСО3(г)=
=88,8 - 39,8 - 213,7 = -164,7 Дж/моль.К.
4.Найдем константу равновесия (при этом DHoр необходимо выразить в джоулях а температуру в Кельвинах).
lgKp
=
![]() =
=
![]() = 10.
= 10.
Kp = 1010.
Пример 6. Определить растворимость поваренной соли в воде при 60 оС.
Решение:
1.Поваренная соль, как и все соли, является сильным электролитом, т.е., растворяясь, она диссоциирует на ионы:
NaCl(тв) ® Na+ + Cl-.
Если х молей соли перешло в раствор, то при этом образовалось х молей каждого из ионов. Поскольку концентрация твердого вещества не входит в выражение зависимости константы равновесия от концентрации реагирующих веществ, то для этой реакции эта зависимость запишется как:
Кс = [Na+] [CL-] = x.x = x2.
Отсюда растворимость х будет равна:
x
=
![]() .
.
2.Определим Кс.
DНор = DНоNa+ + DНоCl- - DНоNaCl=
= (-240,3) + (-167,07) - (-412,0) = 4,7 кДж/моль
DSор = DSNa+ + DSоCl- - DSоNaCl =
58,41 + 56,74 - 72,13 = 43,02 Дж/моль.К.
lgKñ
=
![]() =
=
![]() = 1,51.
= 1,51.
Kñ = 32,4.
Растворимость
х =
![]() =
=![]() =
5,7 моль/л. (Фактическая растворимость
5,4 моль/л).
=
5,7 моль/л. (Фактическая растворимость
5,4 моль/л).
Пример 7. Рассчитать, сколько молей аммиака образуется при достижении химического равновесия, если в при 700 К в реактор емкостью 10 литров, закачать 10 молей водорода и 10 молей азота. Влиянием изменения давления на химическое равновесие пренебречь.
Решение:
1.Начальные концентрации водорода и азота равны 1 моль/л.
2.Рассчитаем константу равновесия (Kð) по изменению энтальпии и энтропии реакции:
N2 + 3H2 « 2 NH3.
DНор = -91,88 кДж/моль. DSoр = -197,94 Дж/моль.К
lgKð
=
![]() = -4,15; Kð
= 7,1.10-5.
= -4,15; Kð
= 7,1.10-5.
3.Рассчитаем Kñ.
а = 1+3 = 4; б = 2.
Kñ = Kð /(RT)б-а = Kð /(RT)2-4 = Kð /(RT)-2 = Kð.(RT)2
Kñ = . 7,1.10-5(0,082.700)2 = 0,233.
4. Выразим Kñ через равновесные концентрации реагирующих веществ.
К моменту равновесия прореагировало х молей и в реакторе осталось (10-х) молей азота. Водорода прореагировало 3х молей и в реакторе осталось (10-3х) молей; соответственно, образовалось 2х молей аммиака. Так как объем реактора равен 10 л, то равновесные концентрации всех реагирующих веществ равны:
[N2]
=
![]() ;
[H2]
=
;
[H2]
=
![]() ;
[NH3]
=
;
[NH3]
=
![]() .
.
Kc
=
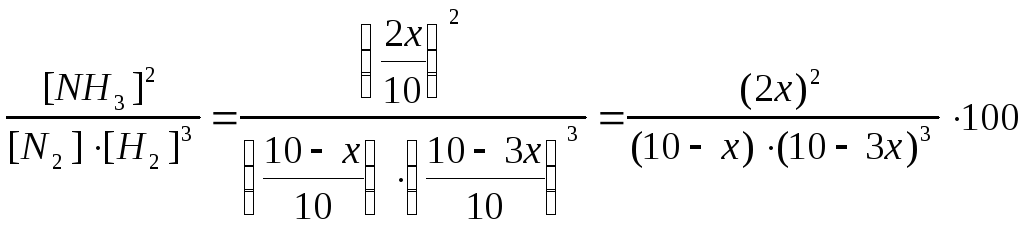 = 0,233.
= 0,233.
![]() =
0,00233.
=
0,00233.
5.Определим х графическим методом, как показано в приложении 8. Для этого определим интервал допустимых значений х. В рассматриваемом случае для N2:10>х>0 è äëÿ H2:10>3х>0, следовательно: 10/3>х>0.
P
=
![]()
По полученным данным х и Р строим таблицу и график.
|
X |
3 |
1 |
1,1 |
1,2 |
1,3 |
|
P
|
5,15
|
0,0013
|
0,0018
|
0,0025
|
0,0344
|

Из графика определяем х=1,18. Таким образом до достижения равновесия в системе образуется 2х=2,36 молей аммиака и равновесная концентрация его будет равна 0,236 моль/л.
Пример 8. В реактор объемом 1 литр при температуре 1000 К закачали 1 моль SO2 и 2 моля О2. В системе устанавливается равновесие:
2 SO2 + O2 « 2SO3.
Определить сколько теплоты выделится к моменту установления равновесия и равновесные концентрации каждого из реагирующих веществ. Влиянием изменения давления пренебречь.
Решение:
1.Рассчитаем константу равновесия (Kð) по изменению энтальпии и энтропии реакции.
DНор = -198 кДж/моль. DSoр = -187 Дж/моль.К
lgKp
=
![]() = +0,6; Kp
= 4.
= +0,6; Kp
= 4.
2.Рассчитаем Kc.
а = 2+1 = 3; б = 2.
Kc = Kp /(RT)б-а = Kp /(RT)2-3 = Kp /(RT)-1 = Kp.(RT)
Kc = 4.0,082.1000 = 328.
3.Выразим Kc через равновесные концентрации реагирующих веществ (учитывая то, что объем реактора - 1 л).
К моменту равновесия прореагировало х молей и в реакторе осталось (2-х) молей кислорода. SO2 прореагировало 2х молей и в реакторе осталось (1-2х) молей; соответственно, образовалось 2х молей SO3. Так как объем реактора равен 1 л, то равновесные концентрации всех реагирующих веществ равны:
[SO2] = 1-2x; [O2] = x; [SO3] = 2x.
Kc
=
![]() =328.
=328.
4.Находим значение х.
Решение уравнений высоких степеней осуществляется графическим способом, если известно, что только один корень уравнения является действительным и известен интервал его значений. В рассматриваемом случае для SO2:1>2х>0, а для O2:2>х>0, следовательно: 0,5>х>0.
В пределах найденного интервала задаем значения х и рассчитываем значение Р, где:
P
=
![]() .
.
Значения х стараемся выбрать так, чтобы величина Р была несколько больше и меньше истинного значения Kc = 328. Результаты представим в виде таблицы.
|
x |
0,4 |
0,3 |
0,45 |
0,47 |
0,48 |
0,485 |
0,475 |
|
P
|
10
|
1,32
|
53
|
160
|
378
|
688
|
237
|
Четыре последние значения Р наиболее близки к величине Kc , по этим значениям строим график зависимости Р от х.

Из полученного графика находим значение х соответствующее Kc = 328: x = 0,478.
5.Химическое равновесие в данной системе установилось при следующих равновесных концентрациях реагирующих веществ: [SO2] = 1-2x = 1-2.0,478 = 1,044 моль/л;
[O2] = x = 0,478 моль/л;
[SO3] = 2x = 2.0,478 = 0,956 моль/л.
6.Тепловой эффект химической реакции равен изменению энтальпии с обратным знаком: Q = -DHop = 198 кДж/моль. Поскольку до установления равновесия образовалось не 2 моля SO3 а 2x = 0,956 молей, мы можем составить пропорцию:
