
- •Основы химической термодинамики
- •Некоторые основные термины и определения
- •Понятие о функции состояния
- •Внутренняя энергия, теплота, работа
- •Первый закон термодинамики. Понятие об энтальпии
- •Тепловой эффект химической реакции
- •Термохимические расчеты
- •Понятие об энтропии и второй закон термодинамики
- •Число микросостояний (термодинамическая вероятность) и энтропия
- •Свойства энтропии Зависимость энтропии от объема
- •Зависимость энтропии от давления
- •Зависимость энтропии от температуры
- •Энергия Гиббса и состояние химического равновесия
- •Химическое равновесие
- •Вопросы для подготовки к семинару и экзамену
- •Примеры решения задач
- •2 Моля so3 - 198 кДж
- •Задачи для домашних заданий
- •Варианты домашних заданий
- •Задача повышенной трудности.
- •Приложение
- •Фундаментальные физические константы
- •Нуль шкалы Цельсия То 273,15 к
Свойства энтропии Зависимость энтропии от объема
Рассмотрим, как изменится энтропия одного моля газа при изменении объема системы.
![]()
Вместо отношения термодинамических вероятностей подставим соответствующую зависимость (3.7) для 1 моля газа:
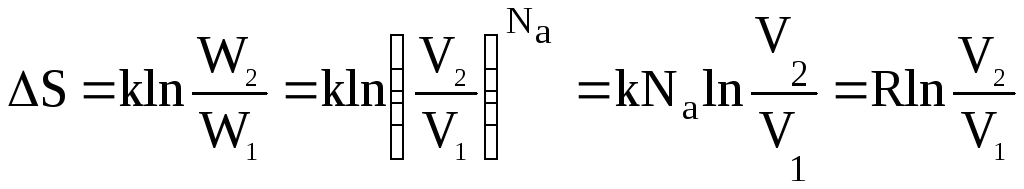 (10)
(10)
R
= 8,31 Дж/моль![]() К,
следовательно:
К,
следовательно:
![]() Дж/моль
Дж/моль![]() К
(11)
К
(11)
Из этого уравнения следует, что процессы, сопровождающиеся увеличением объема системы при сохранении числа молекул, участвующих в процессе, протекают с увеличением энтропии системы.
Зависимость энтропии от давления
Из уравнения состояния идеального газа следует, что для 1 моля газа:
![]() .
.
Подставляя это выражение в уравнение (3.9), получим для изотермического (протекающего при постоянной температуре) процесса:
![]() (12)
(12)
При увеличении давления энтропия системы уменьшается.
Если давление выразить в атмосферах, атмосферное давление обозначить ро (напомним, что ро = 1, а энтропию при этом давлении So, то получим:
![]() ,
,
или
энтропия
![]() при давлении p
равна:
при давлении p
равна:
|
|
(13)
|
Следует обратить внимание, что в уравнении (13) р выражено в абсолютных атмосферах. Если в условиях задачи давление дается в атмосферах избыточных, необходимо перевести его в абсолютные:
рабс. = ризб. +1.
Полученная зависимость (13) характерна только для газовой фазы, на энтропию конденсированных (твердых, жидких) систем изменение давления практически не оказывает влияние, а влияют такие факторы, как тип кристаллической решетки, прочность связей и т.д.
Так, величины энтропии твердого фосфора значительно различаются в зависимости от типа кристаллической решетки («белая» или «красная» модификация):
Sо298,Р(бел) = 41,09 Дж/моль·К; Sо298,Р(кр) = 22,8 Дж/моль·К.
Зависимость энтропии от температуры
С повышением температуры энтропия возрастает.
Действительно
температура повышается за счет подвода
теплоты (по мерее увеличения температуры
становится возможным все большее число
состояний, так как молекулы могут
переходить в состояние со все более
высокими значениями энергии, что приводит
к увеличению термодинамической
вероятности),
![]() При
постоянном давлении и небольшом изменении
температуры (СР
принимается
постоянной)
изменение энтропии системы можно
выразить как, (см. уравнение 8):
При
постоянном давлении и небольшом изменении
температуры (СР
принимается
постоянной)
изменение энтропии системы можно
выразить как, (см. уравнение 8):
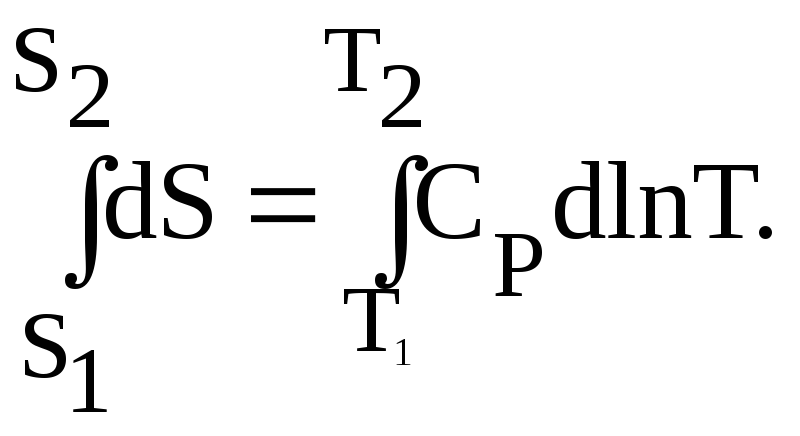 (14)
(14)
Интегрируя это уравнение, получаем следующее выражение:
![]() (14а)
(14а)
На рис. 4. показан характер зависимости энтропии вещества от температуры. Как видно из рисунка 4, при фазовом переходе (ф.п.) вещества (из твердого состояния в жидкое, из жидкого в газообразное состояние) энтропия вещества скачкообразно возрастает, что связано с переходом в состояние с большей неупорядоченностью.
Изменение энтропии вещества при любых фазовых переходах (ф.п.) равно:
|
|
(15) |
Зависимость энтропии вещества от температуры при постоянстве фазового состава определяется уравнением (14а).
В интервале умеренных температур (300 - 500К) этим изменением при ориентировочных расчетах часто пренебрегают.
Уравнение температурной зависимости энтропии 1 моля вещества в пределах одного фазового состояния:
![]() ,
(16)
,
(16)
где Ср – мольная теплоемкость при р = const.
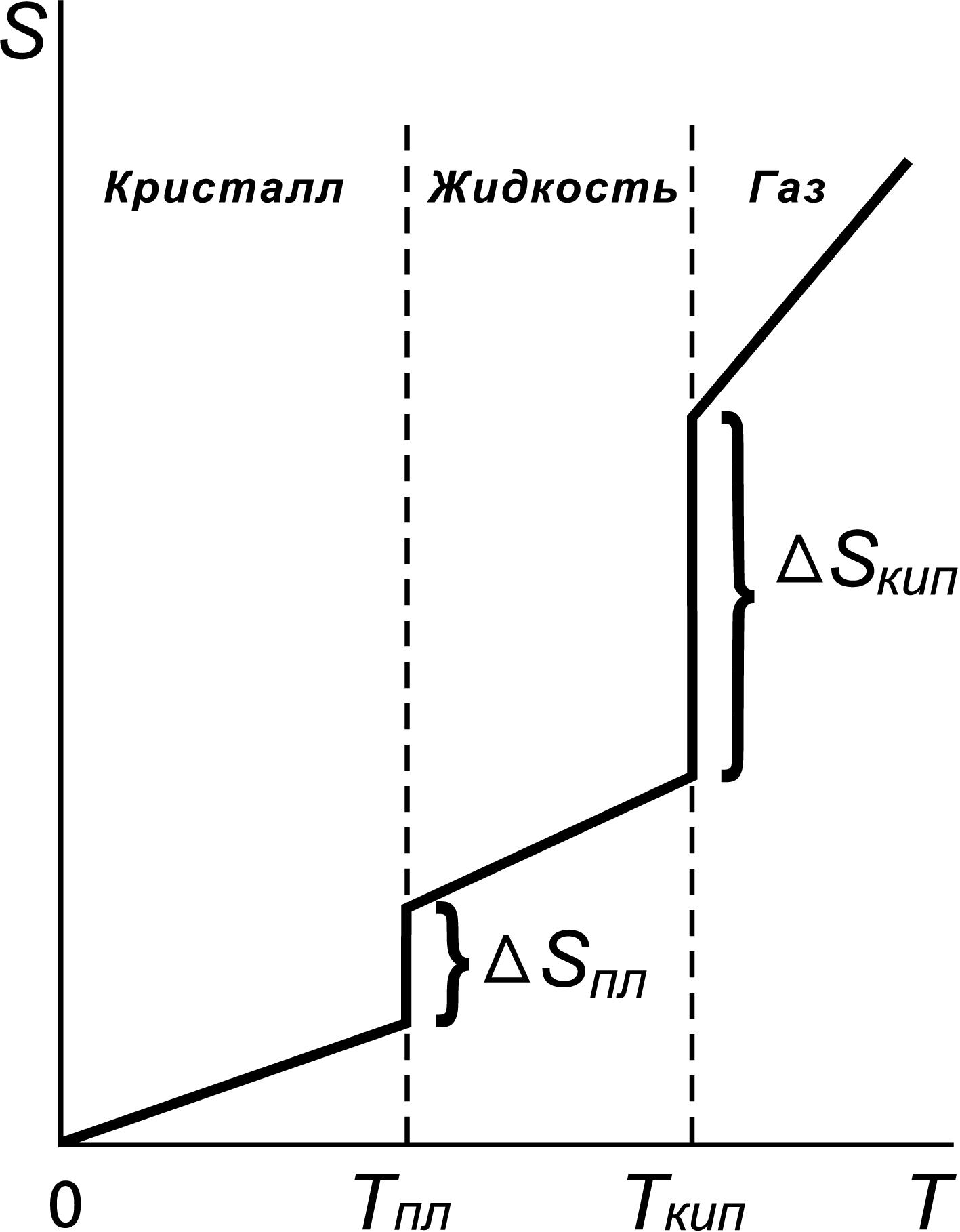
Рис. 4. Зависимость энтропии вещества от температуры.
Принимая Ср = const в интервале температур Т1 и Т2 получаем
![]() .
(17)
.
(17)
Обратите внимание, что зависимость на рис.4 выходит из начала координат. При температуре равной абсолютному нулю тепловое движение отсутствует, все атомы в идеальном кристалле занимают строго определенные места в пространстве. Такое состояние системы может быть реализовано единственным способом, поэтому при этом W = 1, а S = 0. Это третий закон термодинамики, называемый также постулатом Планка.

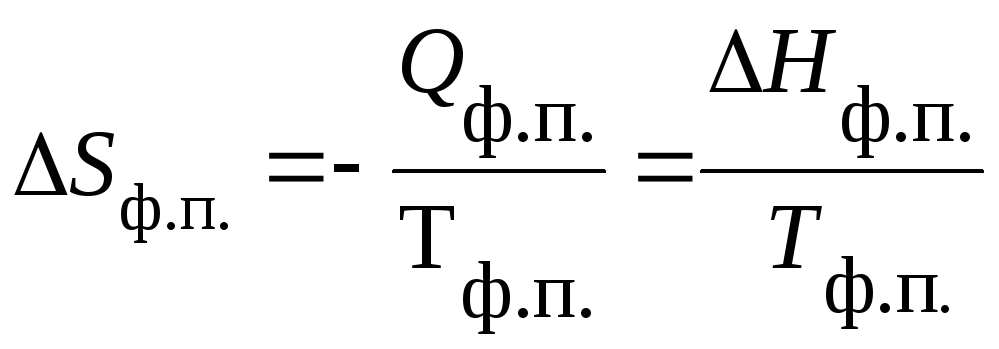 .
.