
- •А.В. Колобов, в.В. Плахтинский, в.В. Соснина пособие для решения задач по органической хими
- •Список сокращений и обозначений
- •Введение
- •1 Пример решения расчётно-графического задания по теме «Алканы»
- •Способы получения и химические свойства алкенов
- •2 Пример решения расчётно-графического задания по теме «Алкены»
- •Способы получения и химические свойства сопряженных диенов
- •Способы получения и химические свойства алкинов
- •3 Пример решения расчётно-графического задания по теме «Диены. Алкины»
- •Химические свойства бензола и его производных
- •4 Пример решения расчётно-графического задания по теме «Арены»
- •5 Пример решения расчётно-графического задания по теме «Галогеналканы. Галогенарены»
- •Литература
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
Способы получения и химические свойства алкенов

2 Пример решения расчётно-графического задания по теме «Алкены»
Задача 2.1
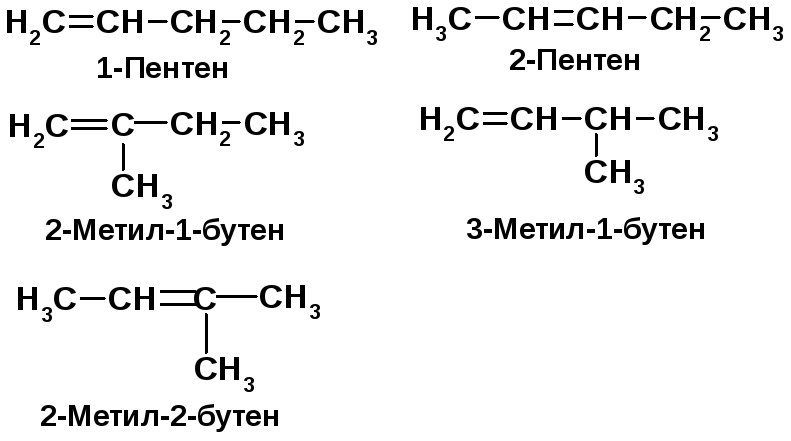
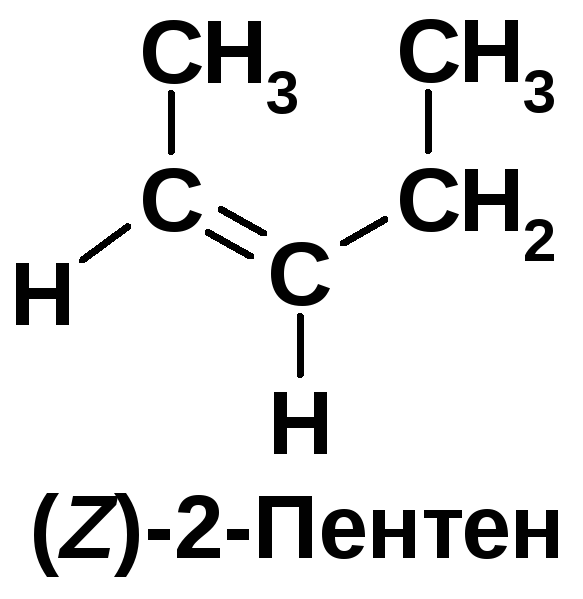
Напишите структурные формулы алкенов состава С5Н10, назовите их. Укажите, какие из написанных алкенов существуют в виде геометрических изомеров, дайте им названия по (Е-, Z-)-номенклатуре.
|
Решение 2.1: |
Напоминание: |
|
|
Главная цепь алкена включает двойную связь. Цепь нумеруется таким образом, чтобы двойная связь имела наименьший номер [3]. |
Указание.
Для выполнения второй части задания необходимо напомним правила (Е, Z)-номенклатуры:
|
1. Определяют относительное старшинство заместителей при атомах углерода с двойной связью. 2. Если две старшие группы 1 расположены по одну сторону от плоскости -связи, то конфигурация - Z (zusammen - вместе), если эти группы находятся по разные стороны, то - Е (entgegen - напротив) [2, c. 63; 3].
Определение старшинства заместителей: 1. Рассматриваются атомы непосредственно связанные с соответствующим атомом углерода при двойной связи. Атом с большим атомным номером является старшим относительно атома с меньшим атомным номером. 2. Если непосредственно соединенные с углеродом атомы одинаковы, то необходимо рассматривают старшинство последующих атомов. |
|
Решение 2.1 (продолжение) |
Напоминание: |
|
|
У второго атома 2 заместителя: водород и метил. Старший – метил, т.к. его атом углерода имеет больший порядковый номер в периодической системе. У третьего атома углерода 2 заместителя: водород и этил. Старший – этил. В первой структуре старшие заместители расположены по разные стороны от плоскости двойной связи. Это (Е)-изомер. У (Z)-изомера старшие группы надо расположить по одну сторону относительно двойной связи. |
Задача 2.2
Напишите структурные формулы соединений: (Е)-2-бром-1-нитро-1-пропен, (Z)-3-метил-2-пентеновая кислота.
|
Решение 2.2: |
Напоминание: |
|
|
Определение старшинства групп ведётся путём сравнения старшинства атомов (см. Заданиие2.1). Атом азота старше атома водорода. Атом брома старше атома углерода. В (Е)-изомере старшие заместители (бром и нитрогруппа) рисуем по разные стороны относительно двойной связи. Атом углерода (карбоксильная группа) старше атома водорода. Метильная группа младше этильной. В (Z)-изомере старшие заместители (карбоксильная и этильная группы) располагаем по одну сторону относительно двойной связи. |
Задача 2.3
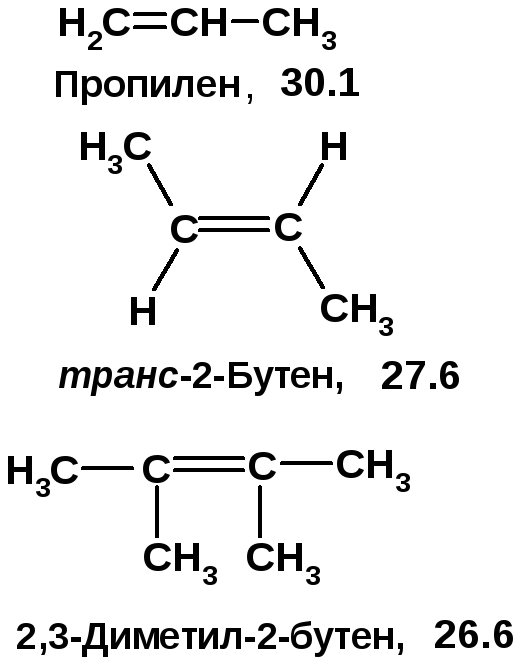
Для пропилена, транс-2-бутена и 2,3-диметил-2-бутена определены теплоты гидрирования: 27.6; 30.1; 26.6 ккал/моль. Укажите величину, соответствующую каждому алкену. Расположите их в ряд по увеличению устойчивости.
|
Решение 2.3: |
Напоминание: |
|
|
Количество теплоты, выделяющейся при гидрировании одного моля ненасыщенного соединения, называется теплотой гидрирования. Чем больше степень алкилирования атомов углерода при двойной связи, тем более устойчив алкен [2, c. 74], тем ниже теплота гидрирования. Транс-изомер устойчивее цис-изомера. |
Задача 2.4
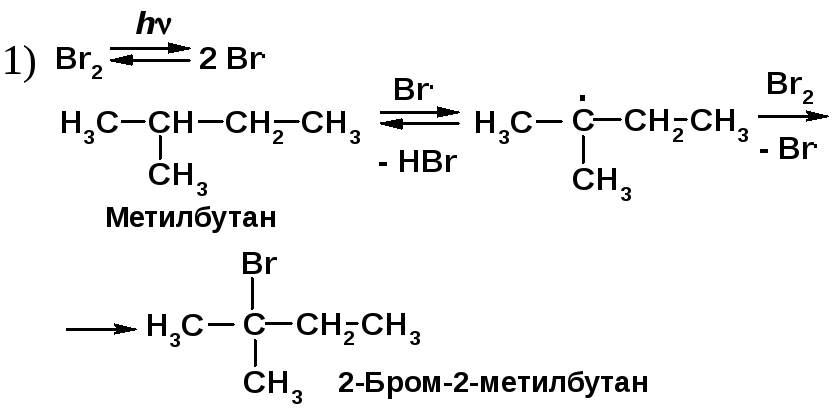
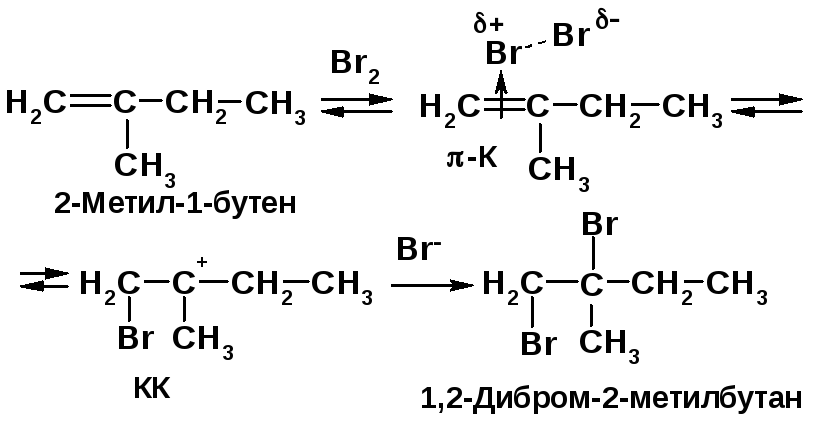
Сравните отношение к брому 1) метилбутана на свету; 2) 2-метил-1-бутена: а) при комнатной температуре в СС14 и б) в газовой фазе при 300 ºС. Приведите механизмы реакций.
|
Решение 2.4: |
Напоминание: |
|
2а) Бромирование 2-метил-1-бутена при комнатной температуре - АЕ -реакция – протекает через образование наиболее стабильного трет-карбокатиона КК:
Лимитирующая стадия АЕ-реакции - перегруппировка -комплекса -К в карбокатион КК. |
Алканы реагируют с бромом при УФ облучении (h) по механизму радикально-цепного замещения SR [2, c. 25].
Алкены реагируют с бромом в инертном растворителе по механизму электрофильного присоединения АЕ [2, c. 75]. |
|
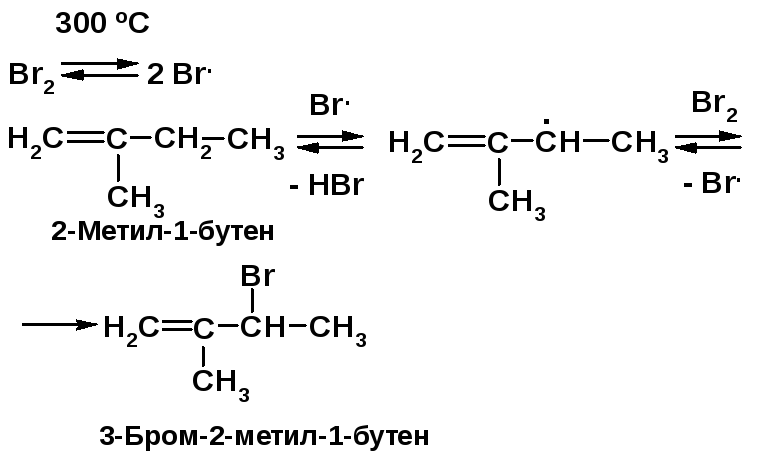
Решение 2.4 (продолжение): |
Напоминание: |
|
2б) Реакция 2-метил-1-бутена с бромом при 300 ºС сопровождается образованием 3-бром-2-метил-1-бутена:
|
Алкены, содержащие -С-Н-связи, реагируют с бромом при повышенной температуре по механизму свободно-радикаль-ного замещения АR с промежуточным образованием стабильного аллильного радикала [2, c. 75]. |
Задача 2.5
Напишите уравнение реакции 2-метил-1-бутена с НВr (в темноте, 20 ºС). Рассмотрите механизм реакции. Приведите энергетическую диаграмму изменения потенциальной энергии в ходе электрофильного присоединения, объясните, почему более устойчивый карбокатион должен образовываться быстрее. Какие продукты образуются при взаимодействии HBr c акрилонитрилом CH3–CH=CH–C≡N?
|
Решение 2.5: |
Напоминание: |
|
Перегруппировка -комплекса (-К) идет в направлении образования третичного карбокатиона КК1. |
Электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона [2, c. 82]. |
|
Решение 2.5 (продолжение): |
Напоминание: |
|
КК1 – более стабилен, чем КК2, из-за смещения электронной плотности к С+-центру с большего числа С-Н-связей в соседних С-атомах. Энергетическая диаграмма:
Устойчивость переходного состояния ПС1 больше (энергия активации Еа меньше), так как ведет к образованию третичного карбокатиона КК1 в медленной стадии.
|
В случае элект-рофильного при-соединения к ал-кенам с электроноакцепто-рными группами при двойной свя-зи, образуется менее неустойчивый карбокатион [2, c. 83]. |
Задача 2.6
Напишите уравнение, рассмотрите механизм реакции, назовите соединения. Учтите возможность перегруппировки.
![]()
|
Решение 2.6: |
Напоминание: |
|
При реакции электрофильного присоединения образовавшийся первоначально вторичный КК1 перегруппировывается в более стабильный КК2 за счет 1,2-алкильного сдвига. |
Реакции электрофильного присоединения протекают через стадию образования карбокатионов (КК) и могут сопровождаться перегруппировками. |
|
Решение 2.6 (продолжение): |
Напоминание: |
|
|
Образовавшийся вто-ричный КК может перегруппировываться в более устойчивый третичный КК за счет переноса гидрид-иона к соседнему С-атому (1,2-гидридный сдвиг, на схеме не представлен) или вместе с миграцией карбаниона H3C углерода (1,2-алкильный сдвиг [2, c. 84]. |
Задача 2.7
В результате озонолиза алкена были получены соединения: ацетон – СН3СОСН3 и пропионовый альдегид - СН3СН2СНО. Установите строение исходного соединения. Напишите уравнения реакции его озонирования и последующего гидролиза.
|
Решение 2.7: |
Напоминание: |
|
R1 = R2 = CH3; R3 = CH3CH2, R4 = H |
При действии озона О3 на алкены получаются озониды, которые при гидролизе в общем случае дают 2 карбонильных соединения. Задачу решают “с конца”, представив общую формулу алкена: R1R2C=C3R4R5. Тогда карбонильные соединения должны иметь структуры: R1-CO-R2 и R3-CO-R4 [2, c. 100]. |
Задача 2.8
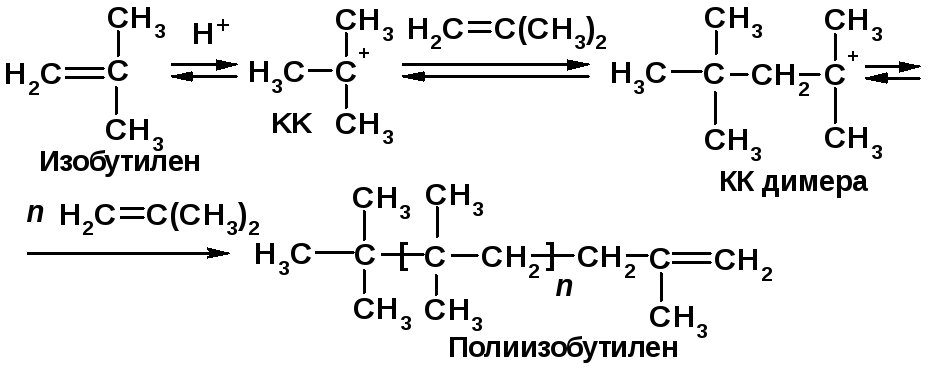
Напишите схему полимеризации изобутилена.
|
Решение 2.8: |
Напоминание: |
|
Присоединение к изобутилену электрофила Н+ приводит к карбокатиону КК, который присоединяет вторую молекулу данного мономера, давая КК димера, и т. д.:
|
Катионная полимеризация протекает по механизму АЕ [2, c. 94]. |
Задача 2.9
Напишите схему совместной полимеризации стирола С6Н5СН=СН2 и метилакрилата Н3С-О-С(О)-СН=СН2:
|
Решение 2.8: |
Напоминание: |
|
In- инициатор |
В зависимости от применяемого инициатора In различают катионную, анионную и радикальную полимеризации. Возможна также координационная полимеризация под действием катализаторов Циглера-Натта [2, сc. 93¸97]. |
Задача 2.10
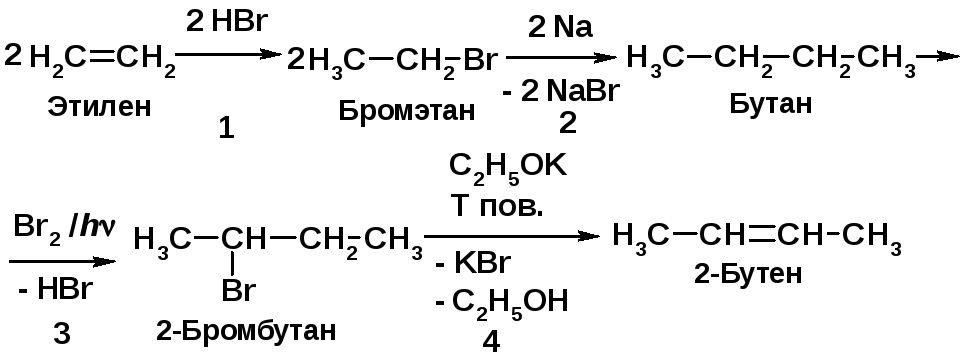
Напишите схемы превращений:

Укажите механизм реакции 1, сформулируйте правило, по которому протекает реакция 4.
|
Решение 2.9: |
Напоминание: |
|
Механизм реакции 1 – электрофильное присоединение – АЕ. Реакция 4 протекает по правилу Зайцева: водород отщепляется от наименее гидрогенизированного атома углерода. |
Алкены присоединяют галогенводороды, давая галогеналканы [2, c. 79]. Галогеналканы по реакции Вюрца дают симметричные алканы [2, c. 34]. Реакция алканов с бромом (h) приводит к бромалканам [2, c. 20]. Бромалканы при действии оснований отщепляют бромоводород [2, c. 102]. |
Задача 2.11
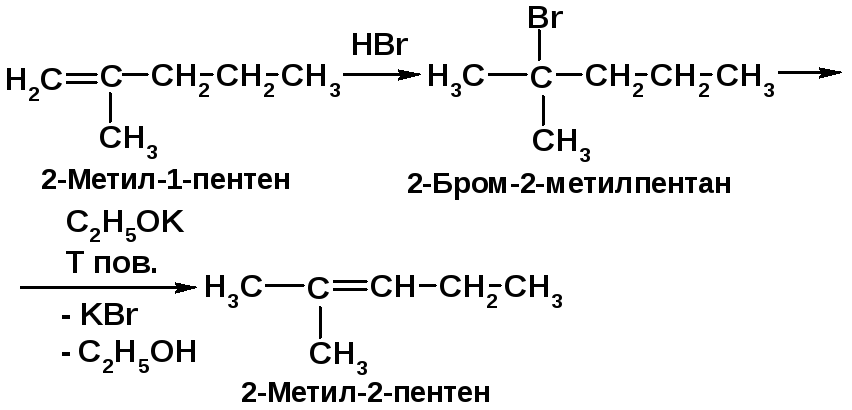
Предложите схему превращения 2-метил-1-пентена в 2-метил-2-пентен.
|
Решение 2.10: |
Напоминание: |
|
|
Электрофильное присоединение HBr протекает по правилу Марковникова, а отщепление – по правилу Зайцева. Таким образом, мо-жно “сдвинуть” двойную связь в некоторых алкенах [2, cc. 79, 227]. |
Задача 2.12
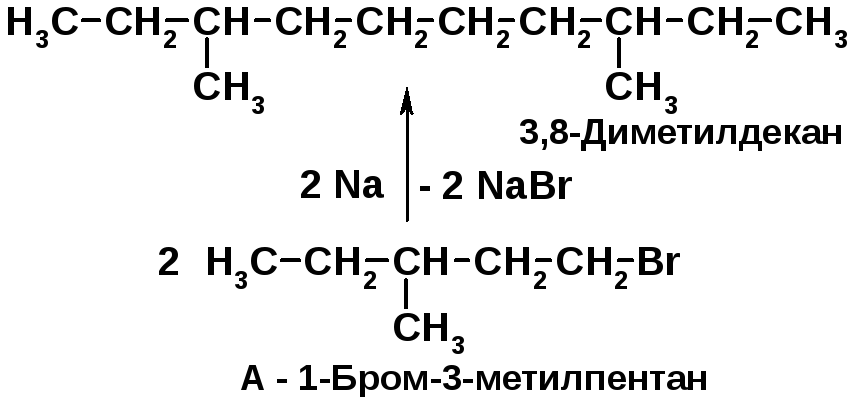
Установите строение соединения А состава С6Н12, если известно, что оно при каталитическом гидрировании превращается в 3-метилпентан, а продукт взаимодействия соединения А с бромистым водородом в присутствии перекиси при нагревании с металлическим натрием дает 3,8-диметилдекан. Напишите уравнения всех перечисленных реакций.
Указание:
Подобные задачи легко решаются, если удаётся найти в условиях задачи ключевую подсказку. В рассматриваемой задаче это образование 3,8-диметилдекана – симметричного алкана, для получения которого используется очевидное исходное соединение (1-бром-3-метилпентан).
|
Решение 2.11: |
Напоминание: |
|
|
Для получения симметричных алканов используют реакцию Вюрца.
1-Бромзамещенные алканы из алкенов получают реакцией 1-алкенов с HBr в присутствии перекиси – AR-реакция [2, с. 87]. Алкены гидрируются водоводом в присутствии катализаторов гидрирования (Ni, Pd) [2, с. 71]. |
Задача 2.13
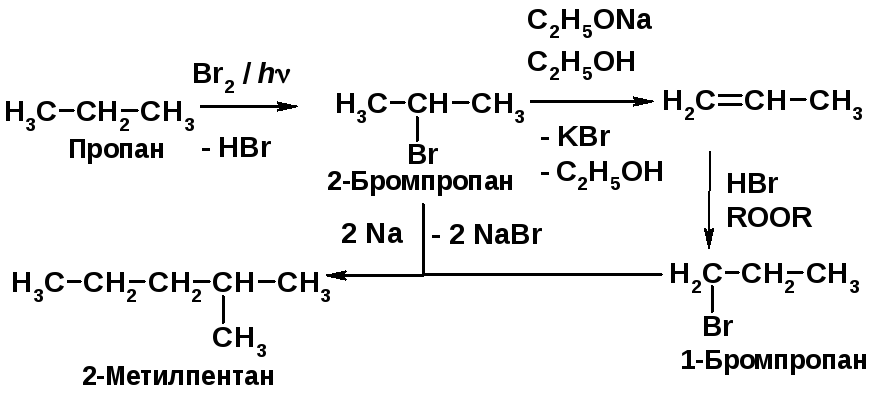
Предложите схему получения 2-метилпентан-2,3-диола на основе пропана и любых неорганических реактивов.
|
Решение 2.13: |
Напоминание: |
|
Для синтеза целевого продукта надо сформировать углеродный скелет молекулы, в данном случае соединить н-С3Н7- и изо-С3Н7-радикалы. |
Реакция алканов с бромом (h) приводит к бромалканам [2, c. 20]. |
|
Решение 2.13 (продолжение): |
Напоминание: |
|
Это достигается синтезом 1- и 2-бромпропанов с последующей перекрестной реакцией Вюрца и выделением необходимого изомера.
|
Бромалканы при действии оснований отщепляют бромоводород [2, c. 102]. 1-Бромзамещенные алканы из алкенов получают реакцией 1-алкенов с HBr в присутствии перекиси – AR-реакция [2, с. 87]. Смесь двух галогеналканов по реакции Вюрца дает несимметричный и два симметричных алкана [2, c. 34]. Взаимодействие алкенов с холодным разбавленным водным раствором KMnO4 приводит к 1,2-диолам [2, c. 34]. |
Вопросы и упражнения
2.1. Какой алкен наиболее активен в реакции присоединения серной кислоты: пропилен или 3,3,3-трифтор-1-пропен? Рассмотрите механизм реакции. Приведите энергетическую диаграмму изменения потенциальной энергии в ходе электрофильного присоединения, объясните, почему более устойчивый карбокатион должен образовываться быстрее. Дайте объяснение, почему соблюдается правило Марковникова [1, c. 31].
2.2. Напишите уравнение, рассмотрите механизм реакции, назовите соединения. Учтите возможность перегруппировки [1, c. 34].
![]()
2.3. При озонолизе соединения C6H12 был получен ацетон (CH3)2CO. Установите строение соединения, напишите уравнения реакций его озонирования и гидролиза полученного озонида [1, c. 36].
2.4. Полимеризацию простых виниловых эфиров проводят под действием кислот и катализаторов – кислот Льюиса (AlCl3, BF3). Приведите механизм реакции полимеризации этилвинилового эфира формулы (СН2=СН-ОС2Н5).
2.5. Напишите уравнения последовательных реакций [1, c. 41]:

2.6233. Используя изобутан и любые неорганические соединения, получите 2,5-диметилгексан и 2-метил-1-пропанол [1, c. 43].
Типичные вопросы, обсуждаемые при защите расчётно-графической работы:
2.7. Какие реакции характерны для алкенов? Каковы их механизмы?
2.8. Каковы условия инициирования радикальных реакций с участием алкенов?
2.9. Что такое карбокатион? Чем определяется устойчивость карбокатиона?
2.10. Современная трактовка: почему соблюдается правило Марковникова?.
2.11. Чем объяснить присоединение галогенводородов к алкенам, протекающее «против правила Марковникова»?
2.12. Как «сдвинуть» концевую двойную связь, например, в 3-метил-1-пентене?
2.13. Какова связь между теплотой гидрирования, устойчивостью (термодинамической стабильностью), теплотой образования ΔH0f алкенов?
2.14. Механизм радикального присоединения галогенводородов к алкенам.
2.15. Аллильное бромирование алкенов: механизм, реагенты, условия. Причины устойчивости аллильного радикала.
2.16. Механизмы полимеризации алкенов.
2.17. Протон, гидрид ион, водород, атом водорода.
2.18. Как из стереохимически чистого цис-алкена получит равновесную смесь цис- и тран-алкена?






 Карбокатион
КК2 крайне неустойчив из-за действия
соседней акцепторной CN-группы.
Протон присоединяется к СН2-группе,
давая менее неустойчивый КК1.
Карбокатион
КК2 крайне неустойчив из-за действия
соседней акцепторной CN-группы.
Протон присоединяется к СН2-группе,
давая менее неустойчивый КК1.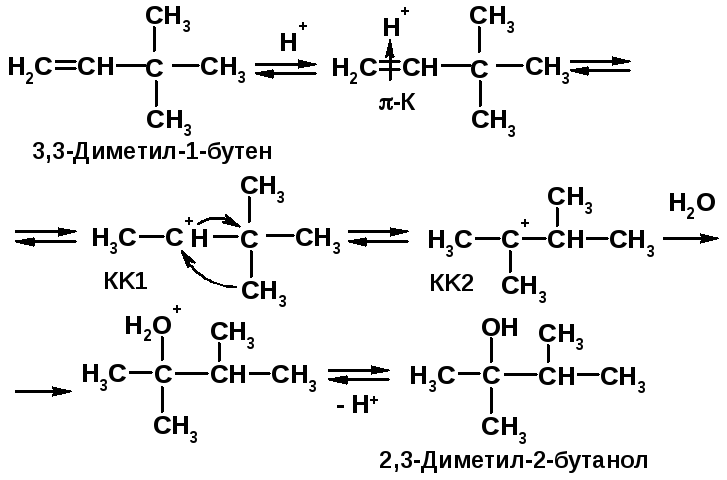


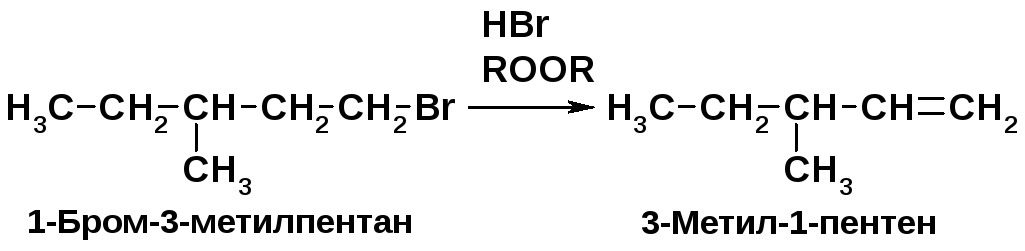

 Последующие
превращения заключаются в реакциях
бромирования, дегидробромирования и
окисления полученного алкена:
Последующие
превращения заключаются в реакциях
бромирования, дегидробромирования и
окисления полученного алкена: