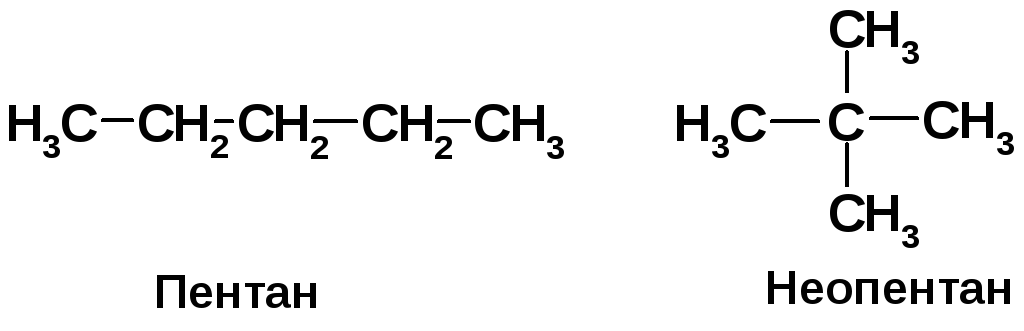- •А.В. Колобов, в.В. Плахтинский, в.В. Соснина пособие для решения задач по органической хими
- •Список сокращений и обозначений
- •Введение
- •1 Пример решения расчётно-графического задания по теме «Алканы»
- •Способы получения и химические свойства алкенов
- •2 Пример решения расчётно-графического задания по теме «Алкены»
- •Способы получения и химические свойства сопряженных диенов
- •Способы получения и химические свойства алкинов
- •3 Пример решения расчётно-графического задания по теме «Диены. Алкины»
- •Химические свойства бензола и его производных
- •4 Пример решения расчётно-графического задания по теме «Арены»
- •5 Пример решения расчётно-графического задания по теме «Галогеналканы. Галогенарены»
- •Литература
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
1 Пример решения расчётно-графического задания по теме «Алканы»
Задача 1.1
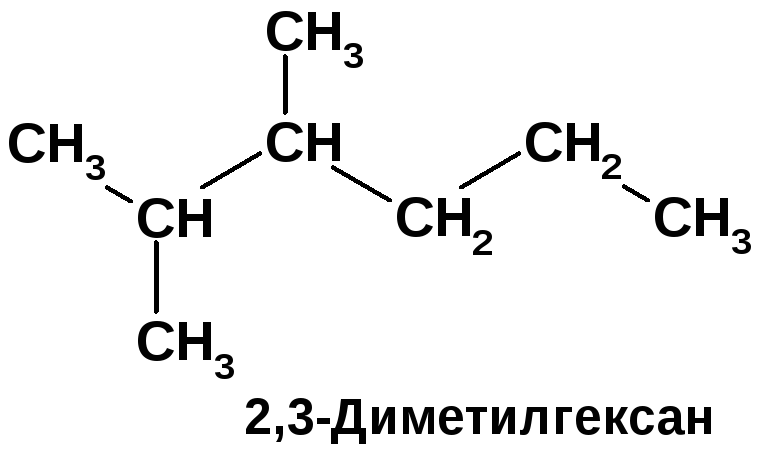
Напишите формулы структурных изомеров состава C8H18 с главной цепью, содержащей шесть атомов углерода. Назовите их.
|
Решение 1.1: |
Напоминание: |
|
|
Изомерами называются соединения, имеющие одинаковый состав, но различное строение и обладающие вследствие этого различными физическими и химическими свойствами. Структурные изомеры - это соединения, имеющие одинаковый состав, но различную последовательность связывания атомов. Пространственными изомерами называются соединения, в которых одинаковые состав и способ связывания атомов, но различное расположение атомов в пространстве [2, c. 2]. |
Задача 1.2
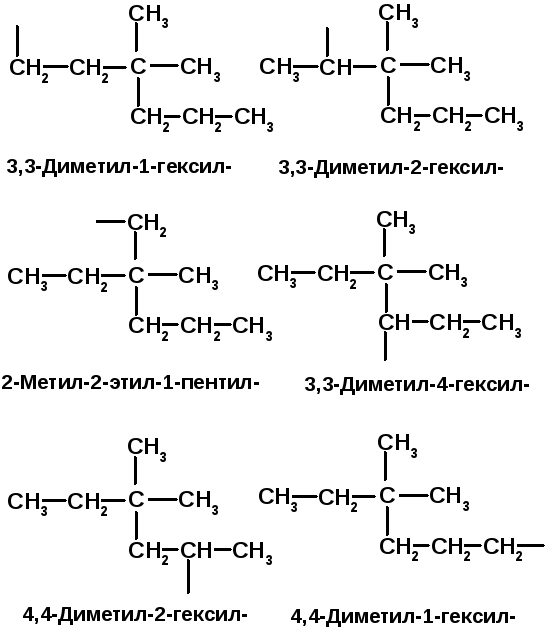
Из приведенных формул выберите формулы:
1) структурных изомеров;
2) соединений, отличающихся только написанием.

Все соединения назовите по номенклатуре IUPAC. В соединении (а) укажите первичные, вторичные, третичные и четвертичные атомы углерода. Напишите формулы одновалентных радикалов, соответствующих углеводороду (в).
|
Решение 1.2: |
Напоминание: |
|
1. Назовём соединения по номенклатуре IUPAC (а) 3,3-диметилпентан; (б) 3,3-диметилгептан; (в) 3,3-диметилгептан; (г) 2,3-диметилпентан.
2. Вещества (б) и (в) имеют одинаковое название. Это одно и тоже соединение. Структуры (б) и (в) отличаются только написанием.
3. Напишем брутто формулы соединений с различными названиями: (а) 3,3-диметилпентан - C7H16; (б) 3,3-диметилгептан - C9H20; (г) 2,3-диметилпентан - C7H16. Вещества (а) - 3,3-диметилпентан и (г) 2,3-диметилпентан – структурные изомеры т.к. имеют одинаковый состав (C7H16), но различную последовательность связывания атомов.
4. Соединение (а):
Атомы углерода в 3,3-диметилпен-тане: 1, 5, 6, 7 – первичные; 2, 4 – вторичные; 3 – четвертичный. |
Выбираем самую длинную цепь атомов углерода – алкан с такой цепью будет рассматриваться как основа для названия. Если имеются цепи с одинаковой длиной, главной выбираем ту, которая имеет наибольшее количество заместителей. Нумеруем её таким образом, чтобы место первого разветвления имело наименьший номер. Указываем номер заместителя и заместитель. Если есть несколько одинаковых заместителей, номер повторяется столько раз, сколько есть одинаковых заместителей. Количество одинаковых боковых цепей обозначают греческими числительными (локантами): ди-, три-, тетра-, пента- и т. д. [3]. Первичным называется атом углерода, соединённый только с одним углеродным атомом, вторичным – с двумя, третичным – с тремя. |
|
Решение 1.2 (продолжение): |
Напоминание: |
|
5. Формулы одновалентных радикалов, соответствующих 3,3-диметилгептану (в):
|
Формулы одновалентных радикалов образуют из соответствующего углеводорода при удалении одного из атомов водорода [3]. Такие радикалы (на примере выделен жирным шрифтом) рассматриваются как заместители в более сложном соединении, например: С6Н5-СН(СН3)-СН(СН3)2 (1,2-Диметил-1-пропил)бензол |
Задача 1.3
Укажите наиболее подходящие галогеналканы для синтеза: 1) 2,5-диметилгексана, 2) 2-метилпентана по способу Вюрца. Какие побочные продукты образуются во втором случае?
|
Решение 1.3: |
Напоминание: |
|
1.Рассмотрение структурной формулы 2,5-диметилгексана приводит к выводу о симметричности молекулы - мысленный разрыв связи между третьим и четвёртым атомами углерода приводит к образованию двух одинаковых радикалов СН3-СН(СН3)-СН2-
|
Реакция Вюрца - взаимодействие галогеналканов (галоген, как правило, бром или хлор) с металлическим натрием. Общая схема превращений:
|
|
Решение 1.3 (продолжение): |
Напоминание: |
|
2. Структура 2-метилпентана не симметрична. Для того чтобы получить это соединений по реакции Вюрца мы должны использовать два галогеналкана различного строения с образованием трех продуктов:
|
Для синтеза несимметричных алканов необходимо применять два бромалкана. |
Задача 1.4
Какие свободные алкильные радикалы могут образовываться из бутана в реакции бромирования? Сравните их устойчивость и легкость образования. Укажите наиболее прочную связь C-H в бутане.
|
Решение 1.4: |
Напоминание: |
|
трет-Бутил – третичный радикал, он легче образуется, чем изобутил (первичный), так как более устойчив - неспаренный электрон делокализован по 9 С-Н-связям. Наиболее прочные связи углерод-водород у первичных атомов углерода в группах СН3. |
Ряд легкости образования радикалов: третичный > вторичный > первичный > Н3С·.совпадает с рядом их устойчивости. Чем устойчивее радикал, тем легче он образуется. Устойчивость радикалов определяется делокализацией неспаренного электрона по С-Н-связям соседних С-атомов [2, c. 24]. |
Задача 1.5
Напишите механизм хлорирования 2,2,3,3-тетраметилбутана. Рассчитайте теплоту реакций отдельных стадий, укажите медленную стадию. Объясните, почему реакция хлорирования протекает при комнатной температуре, а реакция бромирования - при +127 ºС.
Указание.
Для выполнения задания необходимо использовать значения энергий диссоциации связей, образующихся и образующихся в ходе процесса, представленные в таблице:
Таблица - Энергия диссоциации связи(энергия связи)
AB A∙ + B∙
-
AB
кДж.моль
AB
кДж.моль
H-H
435
(CH3)3C-H
381
D-D
444
=CH-H
435
F-F
155
=CHCH2-H
368
Cl-Cl
243
C6H5-H
469
Br-Br
193
C6H5CH2-H
356
I-I
151
CH3-F
452
H-F
565
CH3-Cl
339
H-Cl
431
CH3-Br
293
H-Br
364
CH3-I
234
H-I
297
CH3CH2-F
444
HO-H
498
CH3CH2-Cl
343
CH3-H
427
CH3CH2-Br
289
CH3CH2-H
410
CH3CH2-I
226
(CH3)2CH-H
397
(CH3)2CH-F
439
(CH3)2CH-Cl
339
CH3CH2-CH3
356
(CH3)2CH-Br
285
(CH3)2CH-CH3
351
(CH3)2CH-I
222
(CH3)3C-CH3
335
(CH3)3C-Cl
331
=CH-CH3
385
(CH3)3C-Br
264
=CHCH2-CH3
301
(CH3)3C-I
209
C6H5-CH3
389
CH3-CH3
368
C6H5CH2-CH3
293
|
Решение 1.5: |
Напоминание: |
|
Механизм реакции:
В стадии (3) на разрыв связи Cl–Cl требуется 243·кДж/моль, а выделяющаяся при образовании связи C–Cl энергия равна 331·кДж/моль. Тепловой эффект реакции (3) H(3) = -88 кДж/моль, реакция экзотермична. Реакция (3) более экзотермична, чем реакция (2). Проведя аналогичные расчеты для реакции бромирования, получаем: H(2) = (381 – 364) = 17 кДж/моль, реакция эндотермична; H(3) = (193 – 264) = -71 кДж/моль, реакция экзотермична. Реакция (2) протекает очень медленно, в то время как достаточно быстро. Реакция хлорирования протекает при комнатной температуре, а реакцию бромирования следует проводить при +127 ºС для ускорения стадии (2). |
В свободно-радика-льных процессах определяющим фактором протекания реакции является различие в энергиях разрываемых и образующихся связей [2, c. 14]. |
Задача 1.6
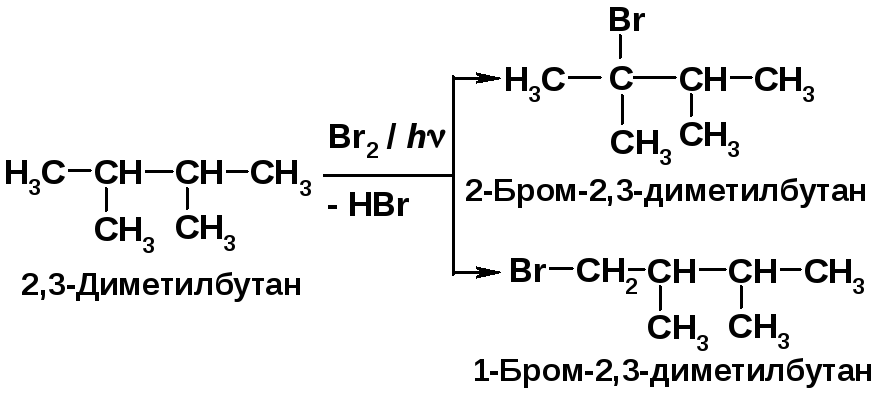
Рассчитайте процентный состав монобромпроизводных, образующихся в реакции бромирования 2,3-диметилбутана. Напишите механизм реакции.
|
Решение 1.6: |
Напоминание: |
|
Схема реакции:
Общая активность двенадцати первичных связей С–Н молекулы равна 12·1 = 12, а двух третичных связей - 2·1600 = 3200. Активность всех химических связей 12+3200 = 3212 - принимается за 100 %. Массовая доля 2,3-диметилбромбутана в продуктах реакции составляет (12:3212) ·100 = 0,4 %, остальные (3200:3212)·100 = 99,6 % приходятся на долю 2-бромзамещённого продукта. Механизм реакции образования основного продукта:
1 – стадия инициирования (зарождения цепи); 2, 3 - стадии продолжения (роста) цепи |
Формула для расчета содержания галогеналканов R-X:
А – активность C-H-связи, n - число соответствующих С-Н-связей. При хлорировании соотношение реакционной способности первичной, вторичной, третичной С–Н-связей составляет 1:3,8:5; при бромировании - 1:82:1600 соответственно [2, c. 27]. Реакция хлорирования протекает с низкой селективностью. Наоборот, реакции значительно менее реакционноспособного брома характеризуются высокой степенью избирательности [2, c. 28]. |
|
Решение 1.6 (продолжение): |
Напоминание: |
|
4, 5, 6 - стадии обрыва цепи. |
|
Задача 1.7
Какое из соединений - пентан или неопентан - более активно в реакции хлорирования? Во сколько раз?
|
Решение 1.7: |
Напоминание: |
|
Активность пентана: 6·1+6·3,8 = 28,8. Активность неопентана: 12·1 = 12. Отношение активностей: 28,8:12 = 2,4. Пентан в реакции хлорирования активнее неопентана в 2,4 раза. |
Аналогично Заданию 5 рассчитываем общую активность соединений [2, c. 27]. |
Задача 1.8
Какой углеводород образуется при электролизе натриевой соли пропионовой кислоты CH3CH2COONa? Напишите механизм реакции. Продукт пронитруйте разбавленной азотной кислотой при повышенных давлении и температуре.
|
Решение 1.8: |
Напоминание: |
|
|
Ацильный радикал, образующийся при электролизе, теряет СО2 и дает алкильный радикал, который рекомбинирует [2, c. 36]. |
|
Решение 1.8 (продолжение): |
Напоминание: |
|
При нитровании, кроме основного продукта (2-нитробутана) образуются другие нитроалканы. |
Нитрование алканов протекает в жестких условиях (радикальное замещение), поэтому наблюдается образование побочных нитроалканов из-за разрыва С-С-связей [2, c. 31]. |
Задача 1.9
Напишите цепочку превращений:

Рассчитать содержание продукта Б в продуктах реакции А→Б. Для реакций А→В и А→Г рассмотреть механизм. Назвать все соединения.
|
Решение 1.9 (продолжение): |
Напоминание: |
|
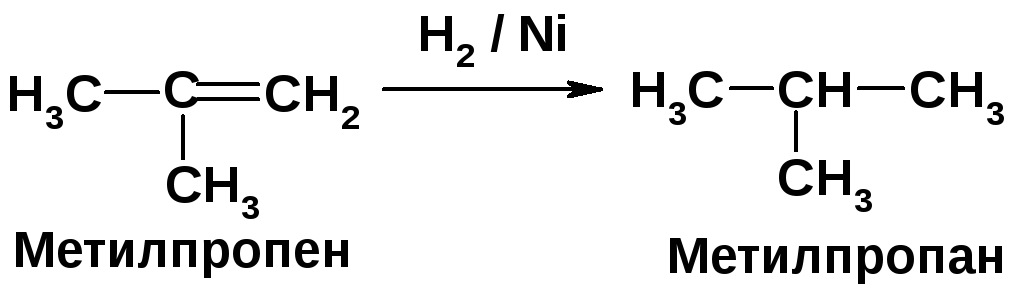
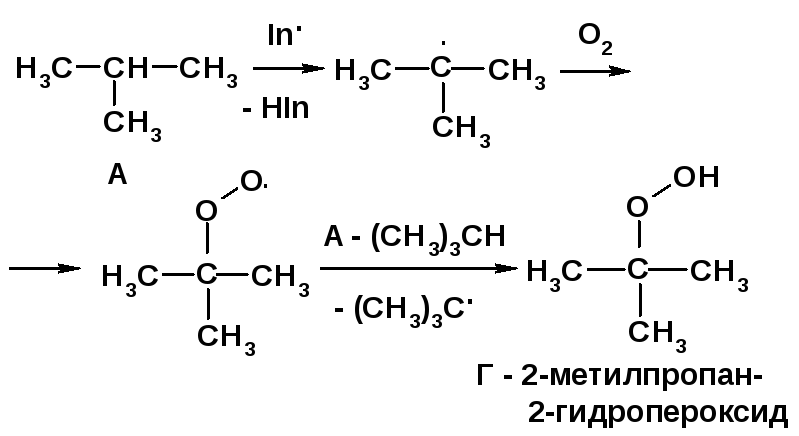
1. На первой стадии происходит каталитическое гидрирование двойной связи:
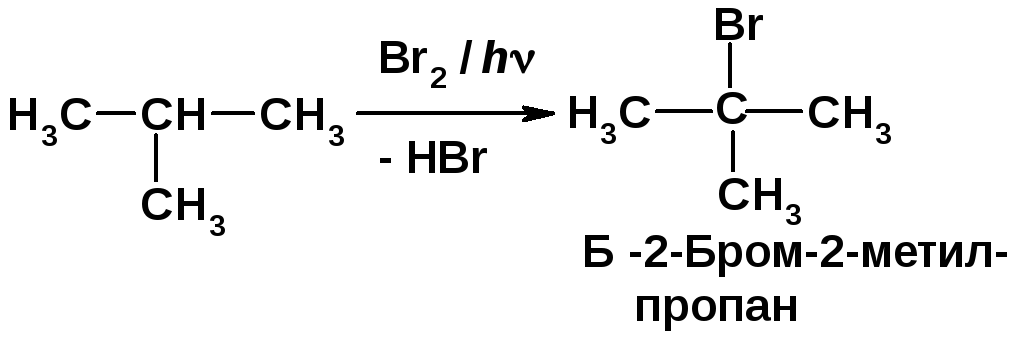
2. Свободно-радикальное бромирование метилпропана протекает в основном с образованием 2-бром-2-метилпропана:
|
Алкены присоединяют молекулярный водород в присутствии катализаторов гидрирования с образованием алканов [2, c. 34]. Свободно-радикальное бромирование протекает в основном по третичному атому углерода ввиду образования наиболее стабильного радикала [2, c. 26]. |
|
Решение 1.9 (продолжение): |
Напоминание: |
|
Общая активность девяти первичных связей разрываемых С–Н в молекуле равна 9·1 = 12, а третичной связи - 1·1600 = 1600. Активность всех химических связей 12+1600 = 1612 - принимается за 100 %. Массовая доля 2-бром-2-метилпропана в продуктах реакции составляет (1600:1612)·100 = 99,2 %. 3. Реакция сульфохлорирования протекает с первоначальным образованием атомарного хлора, взаимодействием его с атомом водорода с генерированием трет-бутил- и изо-бутил-радикалов. Последний присоединяет диоксид серы, который реагирует с молекулярным хлором, образуя сульфохлорид.
4. Автоокисление метилпропана молекулярным кислородом в присутствии инициатора In. приводит к трет-бутилгидропероксиду Г:
|
Сульфохлорирование алканов протекает по радикально-це-пному механизму при облучении При этом третичные продукты не образуются ввиду стерических препятствий при атаке третичного радикала объемной молекулой SO2 [2, c. 31]. |
Задача 1.10
Напишите цепочку превращений:

|
Решение 1.10: |
Напоминание: |
|
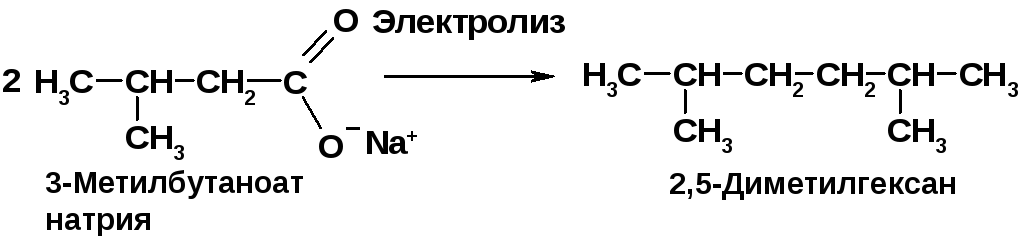
Задачу следует решать “с конца”: 2,5-дибром-2,5-диметилгексан образуется при дибромировании 2,5-диметилгексана.
|
При бромировании алканов образуются преимуществе-нно трет-бромал-каны [2, c. 26].
Алканы образуются при электролизе солей карбоновых кислот [2, c. 36].
При крекинге (500- 700 оС) алканы распадаются с разрывом связи C–C и образованием алканов и алкенов [2, c. 32]. |
Задача 1.11
Установите строение алкилиодида, который при взаимодействии:
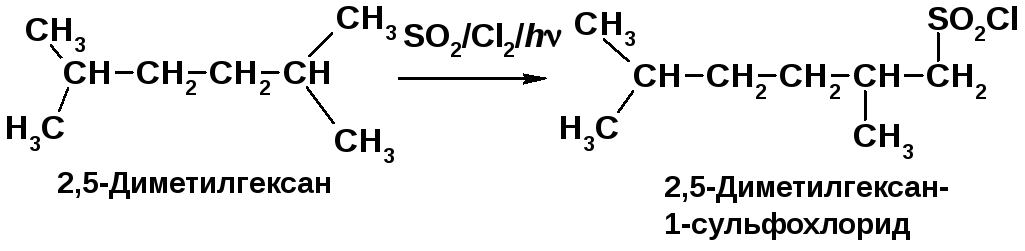
а) с иодоводородом дает метилпропан; б) с натрием по реакции Вюрца образует 2,5-диметилгексан. Напишите уравнения реакций а) и б), проведите реакцию в): 2,5-диметилгексана со смесью диоксида серы и хлора при УФ облучении.
|
Решение 2.11: |
Напоминание: |
|
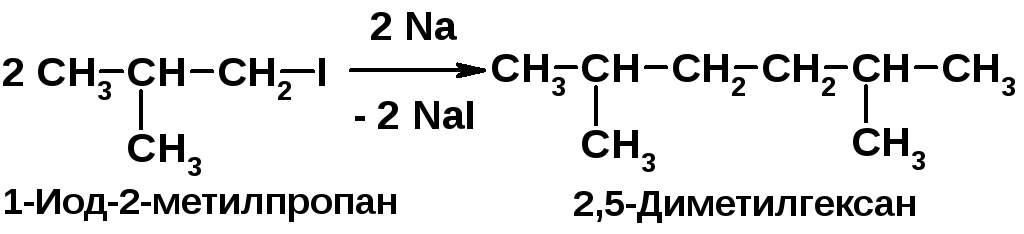
|
Иодалканы восстанавливаются нагреванием с иодоводородом [2, c. 35]. При взаимодействии первичных галогеналканов с металлическим натрием образуются алканы с удвоенным числом атомов углерода [2, c. 34]. В реакции сульфохлорирования замещению не подвергаются Н-атомы при трет-С-атомах из-за пространственных затруднений [2, c. 31]. |
Вопросы и упражнения
1.1. Напишите формулы всех одновалентных радикалов, соответствующих углеводороду 2-метилпентан. Назовите их.
1.2. Укажите наиболее подходящие галогеналканы для синтеза 1) 2,5-диметилгексана и 2) 2-метилгептана по способу Вюрца. Какие побочные продукты образуются во втором случае? [1, с. 15].
1.3. Рассмотрите механизм хлорирования этана. Рассчитайте теплоты реакций стадии развития цепи, укажите реакцию, определяющую скорость хлорирования [1, с. 19].
1.4. Какие свободные алкильные радикалы могут образовываться в реакции хлорирования 2,2,5,5-тетраметилгексана? Сравните их устойчивость, легкость образования. Укажите наименее прочную связь С-Н в данном соединении. Объясните, почему более устойчивый радикал легче образуется [1, с. 20].
1.5. Рассчитайте процентный состав монобромпроизводных, образующихся в реакции бромирования 2-метилпентана. Объясните причину высокой избирательности брома [1, с. 22].
1.6. Напишите уравнения реакций, назовите все соединения [1, с. 24]:

Типичные вопросы, обсуждаемые при защите расчётно-графической работы:
1.7. По какому механизму в основном протекают реакции незамещённых алканов?
1.8. Каковы условия инициирования радикальных реакций с участием алканов?
1.9. Почему реакция Вюрца практически не применяется для получения алканов с нечётным количеством атомов углерода?
1.10. Почему ионные реакции не характерны для незамещённых алканов?
1.11. В каком гибридизованном состоянии находятся атомы углерода в бутане?
1.12. Сырьевая база алифатических соединений.
1.13. Каким образом определяется соотношение реакционной способности первичной, вторичной, третичной С–Н-связей?







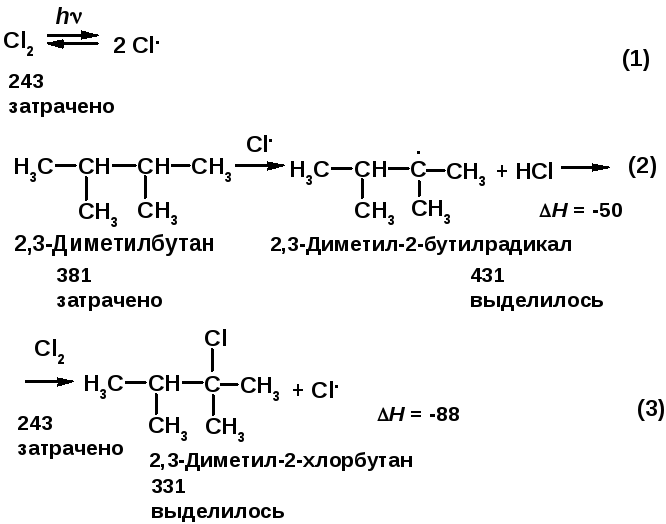 В
стадии продолжения цепи (реакция 2)
затрачивается 381 кДж/моль на разрыв
связи трет-С–Н
в 2,2,3,3-тетраметилбутане
и выделяется 431 кДж/моль при образовании
молекулы HCl.
Реакция (2) экзотермична: тепловой
эффект H(2)
= -50 кДж/моль.
В
стадии продолжения цепи (реакция 2)
затрачивается 381 кДж/моль на разрыв
связи трет-С–Н
в 2,2,3,3-тетраметилбутане
и выделяется 431 кДж/моль при образовании
молекулы HCl.
Реакция (2) экзотермична: тепловой
эффект H(2)
= -50 кДж/моль.