- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
- •Удк 547
- •Удк 547
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •1. Спирты
- •1.1. Физические свойства
- •Сравнение физических свойств спиртов и углеводородов
- •1.2. Химические свойства
- •1.2.1. Реакции с участием связи o−h
- •1.2.2. Реакция с участием связи r–oh
- •1.2.3. Окисление, дегидрирование
- •1.3. Способы получения
- •1.3.1. Гидратация алкенов
- •1.3.2. Гидролиз галогеналканов
- •1.3.3. Синтез с помощью реактива Гриньяра
- •1.3.4. Гидроборирование-окисление алкенов
- •1.3.5. Восстановление карбонильных соединений
- •1.3.6. Брожение сахаров
- •2. Фенолы
- •2.1. Физические свойства
- •Физические свойства фенолов
- •2.2. Химические свойства
- •2.2.1. Кислотность
- •2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
- •2.2.3. Электрофильное замещение в ядре
- •2.2.4. Замещение гидроксигруппы в нитрофенолах
- •2.2.5. Окисление
- •2.2.6. Восстановление
- •3.3. Способы получения
- •4.1. Химические свойства
- •4.2. Способы получения
- •4.2.1. Превращение галогенгидринов под действием оснований
- •4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
- •5. Карбонильные соединения
- •5.1. Строение и физические свойства
- •5.2. Химические свойства
- •5.2.1. Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
- •5.2.2. Нуклеофильное присоединение - отщепление g–nh2 и спиртов
- •5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
- •Реакции, родственные альдольной конденсации
- •5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
- •5.2.5. Галогенирование кетонов - реакции с участием карбанионов
- •5.2.6. Взаимодействие альдегидов и кетонов с пентахлоридом фосфора
- •5.2.7. Восстановление
- •5.2.8. Окисление
- •5.3. Способы получения
- •Названия ацилов и ацилатов некоторых карбоновых кислот
- •6.1. Строение и физические свойства
- •6.2. Химические свойства
- •6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом о–н-связи. Кислотность
- •6.2.2. Реакции, сопровождающиеся разрывом связи с-он. Превращение в функциональные производные
- •6.2.3. Реакции замещения у -углеродного атома.
- •6.2.4. Восстановление кислот
- •7.1.2. Реакции замещения группы х у карбонильного атома углерода
- •7.1.3. Реакции сложного эфира по -углеродному атому
- •7.1.4. Восстановление производных кислот
- •8. Жиры. Воски
- •9. СульфОновые кислоты
- •9.1. Химические свойства
- •9.1.1. Кислотность. Образование солей
- •9.1.2. Превращение в производные кислот
- •Константы кислотности бензолсульфоновой и бензойной кислот и их амидов
- •9.1.3. Реакция замещения сульфогруппы
- •9.1.4. Электрофильное замещение в кольце – seAr
- •9.2. Способы получения
- •10. Дикарбоновые кислоты
- •10.1. Кислотные свойства
- •Физические свойства дикарбоновых кислот
- •10.2. Поведение при нагревании
- •10.3. Способы получения
- •11. Нитросоединения
- •11.1. Строение и физические свойства
- •Некоторые физические свойства нитрометана и ацетона
- •11.2. Химические свойства
- •11.3. Способы получения
- •12.2. Химические свойства
- •12.2.1. Основность
- •12.2.2. Реакции с участием аминогруппы
- •12.2.3. Замещение в кольце ароматических аминов
- •12.2.4. Реакции аминов с азотистой кислотой
- •12.3. Способы получения
- •12.3.1. Восстановление азотсодержащих соединений:
- •12.3.2. Взаимодействие галогенпроизводных с аммиаком или аминами
- •12.3.3. Взаимодействие спиртов с аммиаком или аминами
- •12.3.4. Восстановительное аминирование
- •12.3.5. Расщепление амидов по Гофману
- •13. Диазосоединения. Соли диазония
- •13.1. Свойства солей диазония
- •1. Синтез п-нитроанилинового красного.
- •2. Синтез метилоранжа
- •14. Кетокислоты
- •Физические свойства некоторых кетокислот
- •15. Оксикислоты
- •Физические свойства некоторых оксикислот
- •16. ,-Непредельные карбонильные соединения
- •17. Аминокислоты
- •17.1. Кофигурация аминокислот
- •17.2. Кислотно-основные свойства
- •Аминокислоты
- •17.3. Способы получения
- •О г л а в л е н и е
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
3.3. Способы получения
3.3.1. Синтез Вильямсона - взаимодействие галогенпроизводных с алкоксидами и феноксидами
В лабораторных условиях простые эфиры получают по реакции Вильямсона взаимодействием галогенпроизводных, способных вступать в реакции SN2, с алкоксид- и феноксид-ионами. Реакция с хорошим выходом протекает с галогенметанами и первичными галогеналканами. В случае вторичных галогеналканов реакция Вильямсона может быть осложнена побочной реакцией элиминирования.
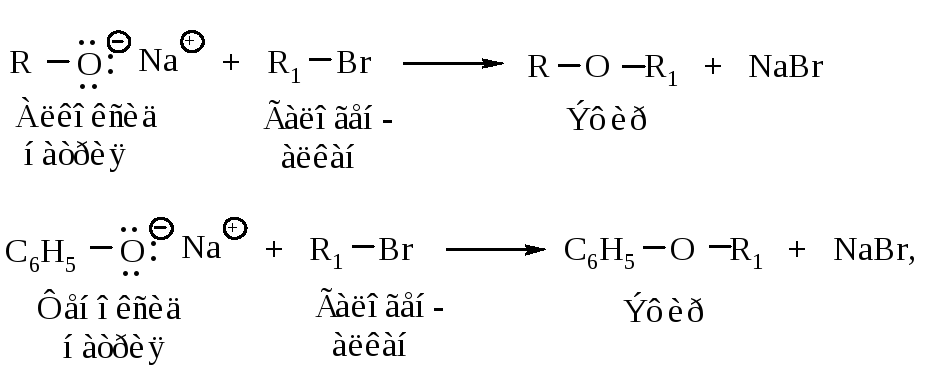
где R1 - первичный или вторичный алкил.
При применении алкилтозилатов получение простых эфиров проходит еще более гладко.
![]()
3.3.2. Межмолекулярная дегидратация спиртов
По этой реакции с хорошим выходом из первичных спиртов могут быть получены симметричные простые эфиры (см. п. 1.2.2).
![]()
Вторичные и третичные спирты при нагревании в присутствии минеральных кислот отщепляют воду, превращаясь в алкены.
В отличие от других вторичных и третичных спиртов изопропиловый спирт дает неплохой выход диизопропилового эфира.

3.3.3. Присоединение спиртов к алкенам
Действием спиртов на алкены в присутствии кислотных катализаторов в промышленности получают несимметричные простые эфиры (АЕ).

4. ПРОСТЫЕ ЦИКЛИЧЕСКИЕ ЭФИРЫ. ОКСИРАНЫ
Простые циклические трехчленные эфиры имеют важное значение в качестве промежуточных соединений в органических синтезах. Их называют оксиранами или эпоксисоединениями. Основу названия этих соединений составляет наименование углеводорода, наличие кислородного мостика обозначают префиксом эпокси-. Название такого эфира может быть образовано и как производное оксирана.
Название по радикально-функциональной номенклатуре образуют как название оксидов соответствующих алкенов; их примеры даны в скобках.
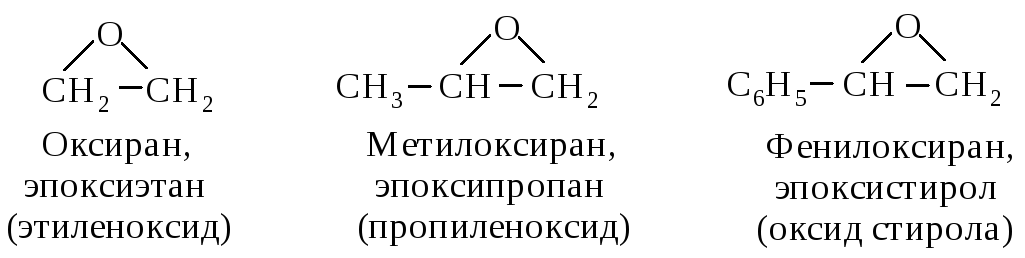
Кроме того, трехчленные циклические эфиры часто называют эпоксидами.
4.1. Химические свойства
Трехчленные циклические эфиры представляют собой простые эфиры, но трехчленный цикл, подобно циклопропану, является сильно напряженным и легко раскрывается в мягких условиях. Поэтому они очень реакционноспособные соединения.
Реакции, катализируемые кислотами. Оксираны в присутствии кислот превращаются в ионы оксония, которые вступают в реакции замещения с большим количеством нуклеофильных реагентов.
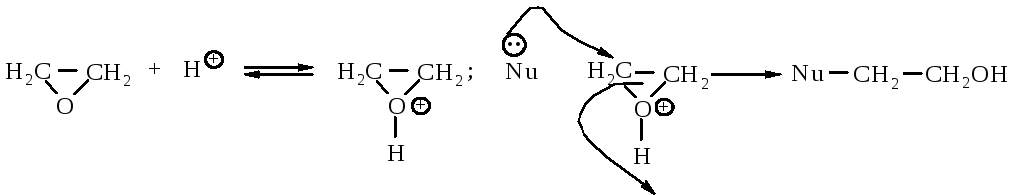
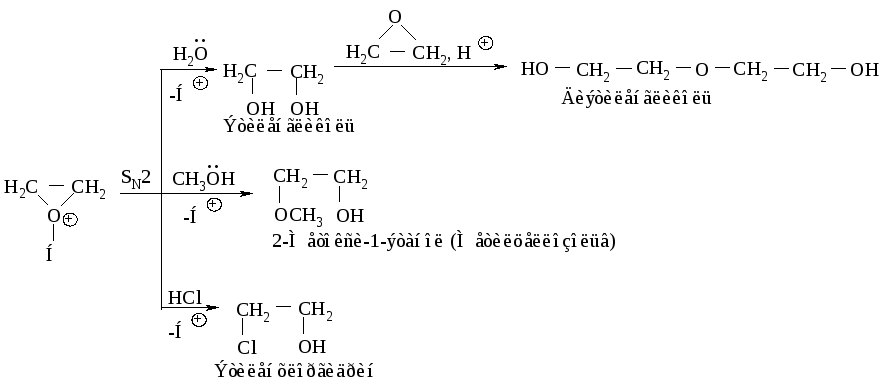
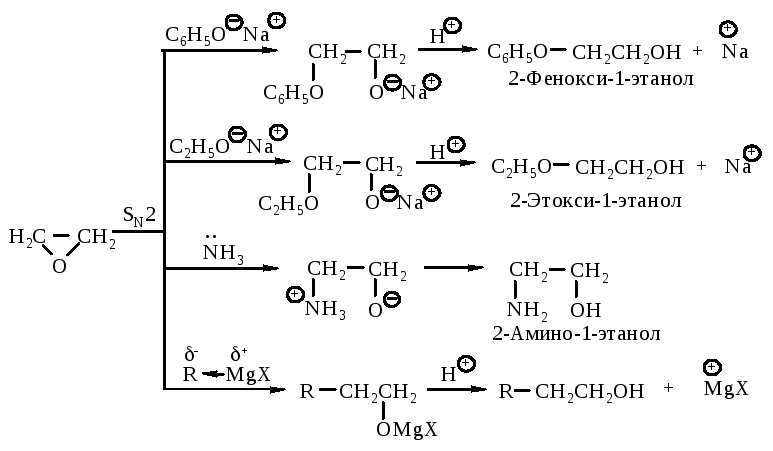
Реакции раскрытия кольца непротонированной эпокиси. Более сильный нуклеофильный характер реагента компенсирует более низкую реакционную способность непротонированной эпокиси.
Четырехчленный
циклический эфир - оксид триметилена
(СН2)3О
расщепляется
труднее, чем этиленоксид. Оксид
тетраметилена
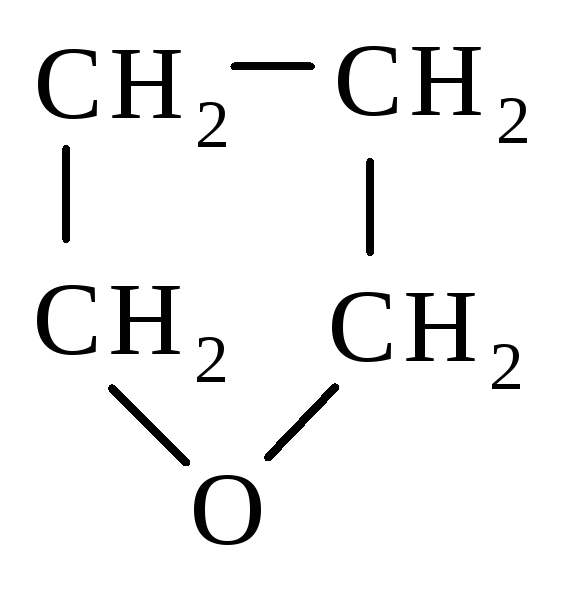
(тетрагидрофуран) представляет собой устойчивое соединение, которое часто используется в качестве растворителя.
4.2. Способы получения
4.2.1. Превращение галогенгидринов под действием оснований
Алкены реагируют с галогенами в присутствии воды с образованием галогенгидринов, при обработке которых щелочью образуется эпоксид.
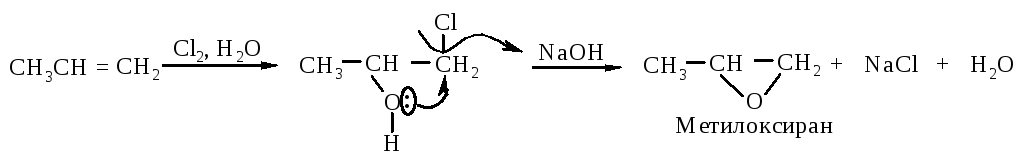
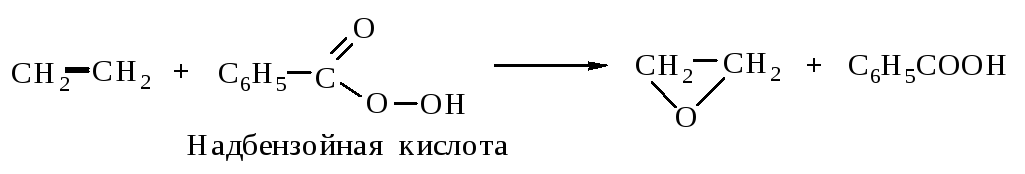
4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
Гидропероксиды карбоновых кислот (надкислоты) количественно превращают алкены в эпоксиды.