
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
- •Удк 547
- •Удк 547
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •1. Спирты
- •1.1. Физические свойства
- •Сравнение физических свойств спиртов и углеводородов
- •1.2. Химические свойства
- •1.2.1. Реакции с участием связи o−h
- •1.2.2. Реакция с участием связи r–oh
- •1.2.3. Окисление, дегидрирование
- •1.3. Способы получения
- •1.3.1. Гидратация алкенов
- •1.3.2. Гидролиз галогеналканов
- •1.3.3. Синтез с помощью реактива Гриньяра
- •1.3.4. Гидроборирование-окисление алкенов
- •1.3.5. Восстановление карбонильных соединений
- •1.3.6. Брожение сахаров
- •2. Фенолы
- •2.1. Физические свойства
- •Физические свойства фенолов
- •2.2. Химические свойства
- •2.2.1. Кислотность
- •2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
- •2.2.3. Электрофильное замещение в ядре
- •2.2.4. Замещение гидроксигруппы в нитрофенолах
- •2.2.5. Окисление
- •2.2.6. Восстановление
- •3.3. Способы получения
- •4.1. Химические свойства
- •4.2. Способы получения
- •4.2.1. Превращение галогенгидринов под действием оснований
- •4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
- •5. Карбонильные соединения
- •5.1. Строение и физические свойства
- •5.2. Химические свойства
- •5.2.1. Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
- •5.2.2. Нуклеофильное присоединение - отщепление g–nh2 и спиртов
- •5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
- •Реакции, родственные альдольной конденсации
- •5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
- •5.2.5. Галогенирование кетонов - реакции с участием карбанионов
- •5.2.6. Взаимодействие альдегидов и кетонов с пентахлоридом фосфора
- •5.2.7. Восстановление
- •5.2.8. Окисление
- •5.3. Способы получения
- •Названия ацилов и ацилатов некоторых карбоновых кислот
- •6.1. Строение и физические свойства
- •6.2. Химические свойства
- •6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом о–н-связи. Кислотность
- •6.2.2. Реакции, сопровождающиеся разрывом связи с-он. Превращение в функциональные производные
- •6.2.3. Реакции замещения у -углеродного атома.
- •6.2.4. Восстановление кислот
- •7.1.2. Реакции замещения группы х у карбонильного атома углерода
- •7.1.3. Реакции сложного эфира по -углеродному атому
- •7.1.4. Восстановление производных кислот
- •8. Жиры. Воски
- •9. СульфОновые кислоты
- •9.1. Химические свойства
- •9.1.1. Кислотность. Образование солей
- •9.1.2. Превращение в производные кислот
- •Константы кислотности бензолсульфоновой и бензойной кислот и их амидов
- •9.1.3. Реакция замещения сульфогруппы
- •9.1.4. Электрофильное замещение в кольце – seAr
- •9.2. Способы получения
- •10. Дикарбоновые кислоты
- •10.1. Кислотные свойства
- •Физические свойства дикарбоновых кислот
- •10.2. Поведение при нагревании
- •10.3. Способы получения
- •11. Нитросоединения
- •11.1. Строение и физические свойства
- •Некоторые физические свойства нитрометана и ацетона
- •11.2. Химические свойства
- •11.3. Способы получения
- •12.2. Химические свойства
- •12.2.1. Основность
- •12.2.2. Реакции с участием аминогруппы
- •12.2.3. Замещение в кольце ароматических аминов
- •12.2.4. Реакции аминов с азотистой кислотой
- •12.3. Способы получения
- •12.3.1. Восстановление азотсодержащих соединений:
- •12.3.2. Взаимодействие галогенпроизводных с аммиаком или аминами
- •12.3.3. Взаимодействие спиртов с аммиаком или аминами
- •12.3.4. Восстановительное аминирование
- •12.3.5. Расщепление амидов по Гофману
- •13. Диазосоединения. Соли диазония
- •13.1. Свойства солей диазония
- •1. Синтез п-нитроанилинового красного.
- •2. Синтез метилоранжа
- •14. Кетокислоты
- •Физические свойства некоторых кетокислот
- •15. Оксикислоты
- •Физические свойства некоторых оксикислот
- •16. ,-Непредельные карбонильные соединения
- •17. Аминокислоты
- •17.1. Кофигурация аминокислот
- •17.2. Кислотно-основные свойства
- •Аминокислоты
- •17.3. Способы получения
- •О г л а в л е н и е
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
2.2. Химические свойства
Химические свойства фенолов определяются наличием в молекуле полярной группы -ОН. В основном эти реакции связаны с кислотностью фенола и электрофильным замещением в ядре. При этом атом кислорода всегда остается в молекуле. Для нуклеофильного замещения группы -ОН нужны очень жесткие условия, и эти реакции мало изучены. Следует отметить, что реакции нуклеофильного замещения с участием феноксид-иона идут легче, чем с участием фенола.
2.2.1. Кислотность
Фенолы более сильные кислоты, чем вода (Ка~10-16) и спирты (Ка~10-18), но значительно более слабые, чем карбоновые кислоты (Kа~10-5). Большинство фенолов имеют Ка~10-10. Гидроксигруппа, связанная с ароматическим ядром, является более кислой, чем группа ОН в воде и спирте, вследствие делокализации электронной пары феноксид-иона, изображенной с помощью граничных структур I - IV.

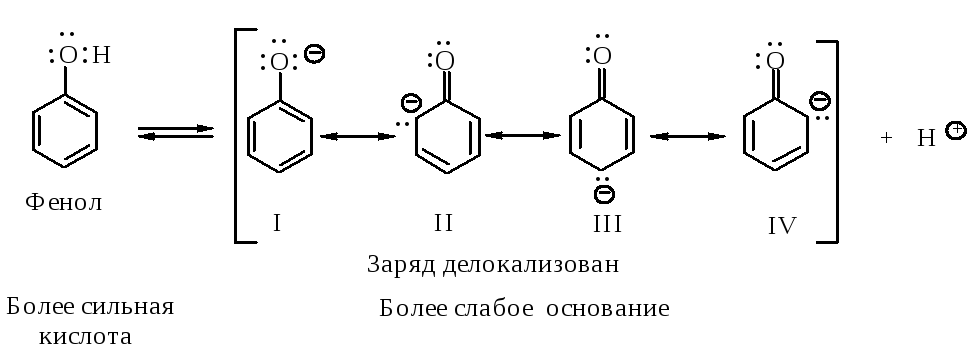
Ряд изменения кислотности и основности можно представить следующим образом:
Относительная
основность:
Относительная
кислотность:![]()
Влияние заместителей на кислотность фенолов
|
G
– электроноакцепторная группа:
–NO2,–Hal,
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность |
G – электронодонорная группа: –СН3, –С2Н5; подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность |
Повышенная кислотность фенолов по сравнению с водой и со спиртами проявляется в способности фенолов образовывать с водными растворами щелочей и спиртовыми растворами алкоксидов соли, называемые феноксидами (фенолятами).

Фенолы, в отличие от карбоновых кислот, не растворяются в водном растворе гидрокарбоната натрия, но их можно выделить из соли действием угольной кислоты

Нерастворимое в воде соединение, которое растворяется в водном растворе щелочи, но не растворяется в водном растворе гидрокарбоната, с большой долей вероятности является фенолом.
Способность фенолов растворяться в водных растворах щелочей используют для выделения фенолов из смесей с нейтральными или менее кислыми соединениями, а также как качественную реакцию на фенол.
Большинство
фенолов (как и енолов) дают характерное
окрашивание с водным и спиртовым
раствором хлорида железа (III) FеС13
вследствие образования комплексных
солей железа
(цветная
качественная реакция на фенолы).
При этом фенол окрашивается в
красно-фиолетовый цвет, крезол - в синий,
резорцин - в темно-фиолетовый, а салициловая
кислота
![]() -
в красный цвет.
-
в красный цвет.
2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
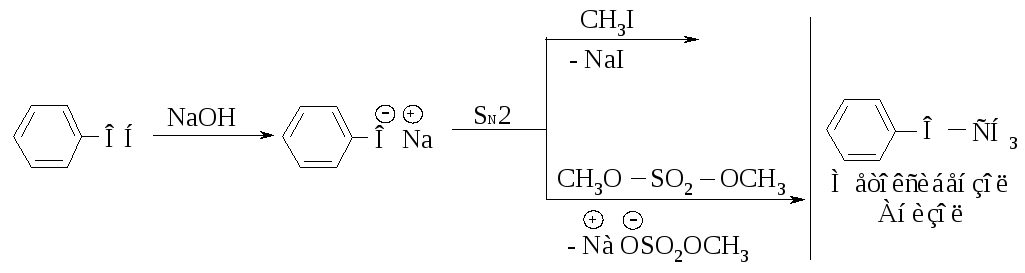
Образование простых эфиров - О-алкилирование фенолов. Реакции фенолов, в которых происходит разрыв связи О-Н и образование новых связей с углеродом, сходны с соответствующими реакциями спиртов. Фенолы как нуклеофилы не реагируют даже с самыми реакционноспособными галогеналканами. Феноксид-ион реагирует с галогеналканами, алкилсульфатами, способными вступать в реакции SN2, с образованием простых эфиров (реакция Вильямсона).
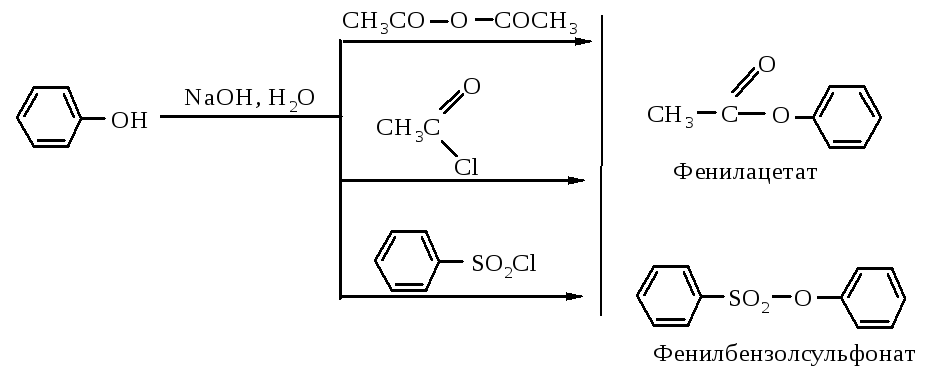
Образование сложных эфиров - О-ацилирование фенолов. Как и спирты, фенолы можно превратить в сложные эфиры реакцией с ангидридами и галогенангидридами карбоновых и сульфоновых кислот.
При
нагревании сложных эфиров фенолов с
хлористым алюминием происходит
перемещение ацильной группы
![]() в о-
или п-положение
кольца с образованием ароматического
кетона
(перегруппировка
Фриса).
в о-
или п-положение
кольца с образованием ароматического
кетона
(перегруппировка
Фриса).


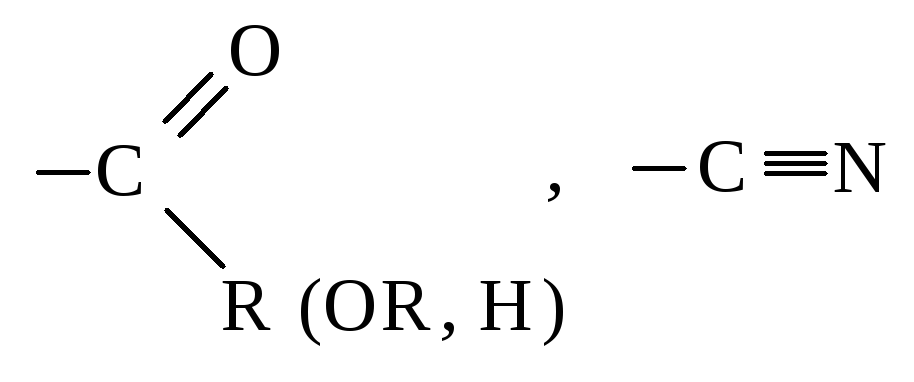 ;
;