
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
- •Удк 547
- •Удк 547
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •1. Спирты
- •1.1. Физические свойства
- •Сравнение физических свойств спиртов и углеводородов
- •1.2. Химические свойства
- •1.2.1. Реакции с участием связи o−h
- •1.2.2. Реакция с участием связи r–oh
- •1.2.3. Окисление, дегидрирование
- •1.3. Способы получения
- •1.3.1. Гидратация алкенов
- •1.3.2. Гидролиз галогеналканов
- •1.3.3. Синтез с помощью реактива Гриньяра
- •1.3.4. Гидроборирование-окисление алкенов
- •1.3.5. Восстановление карбонильных соединений
- •1.3.6. Брожение сахаров
- •2. Фенолы
- •2.1. Физические свойства
- •Физические свойства фенолов
- •2.2. Химические свойства
- •2.2.1. Кислотность
- •2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
- •2.2.3. Электрофильное замещение в ядре
- •2.2.4. Замещение гидроксигруппы в нитрофенолах
- •2.2.5. Окисление
- •2.2.6. Восстановление
- •3.3. Способы получения
- •4.1. Химические свойства
- •4.2. Способы получения
- •4.2.1. Превращение галогенгидринов под действием оснований
- •4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
- •5. Карбонильные соединения
- •5.1. Строение и физические свойства
- •5.2. Химические свойства
- •5.2.1. Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
- •5.2.2. Нуклеофильное присоединение - отщепление g–nh2 и спиртов
- •5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
- •Реакции, родственные альдольной конденсации
- •5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
- •5.2.5. Галогенирование кетонов - реакции с участием карбанионов
- •5.2.6. Взаимодействие альдегидов и кетонов с пентахлоридом фосфора
- •5.2.7. Восстановление
- •5.2.8. Окисление
- •5.3. Способы получения
- •Названия ацилов и ацилатов некоторых карбоновых кислот
- •6.1. Строение и физические свойства
- •6.2. Химические свойства
- •6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом о–н-связи. Кислотность
- •6.2.2. Реакции, сопровождающиеся разрывом связи с-он. Превращение в функциональные производные
- •6.2.3. Реакции замещения у -углеродного атома.
- •6.2.4. Восстановление кислот
- •7.1.2. Реакции замещения группы х у карбонильного атома углерода
- •7.1.3. Реакции сложного эфира по -углеродному атому
- •7.1.4. Восстановление производных кислот
- •8. Жиры. Воски
- •9. СульфОновые кислоты
- •9.1. Химические свойства
- •9.1.1. Кислотность. Образование солей
- •9.1.2. Превращение в производные кислот
- •Константы кислотности бензолсульфоновой и бензойной кислот и их амидов
- •9.1.3. Реакция замещения сульфогруппы
- •9.1.4. Электрофильное замещение в кольце – seAr
- •9.2. Способы получения
- •10. Дикарбоновые кислоты
- •10.1. Кислотные свойства
- •Физические свойства дикарбоновых кислот
- •10.2. Поведение при нагревании
- •10.3. Способы получения
- •11. Нитросоединения
- •11.1. Строение и физические свойства
- •Некоторые физические свойства нитрометана и ацетона
- •11.2. Химические свойства
- •11.3. Способы получения
- •12.2. Химические свойства
- •12.2.1. Основность
- •12.2.2. Реакции с участием аминогруппы
- •12.2.3. Замещение в кольце ароматических аминов
- •12.2.4. Реакции аминов с азотистой кислотой
- •12.3. Способы получения
- •12.3.1. Восстановление азотсодержащих соединений:
- •12.3.2. Взаимодействие галогенпроизводных с аммиаком или аминами
- •12.3.3. Взаимодействие спиртов с аммиаком или аминами
- •12.3.4. Восстановительное аминирование
- •12.3.5. Расщепление амидов по Гофману
- •13. Диазосоединения. Соли диазония
- •13.1. Свойства солей диазония
- •1. Синтез п-нитроанилинового красного.
- •2. Синтез метилоранжа
- •14. Кетокислоты
- •Физические свойства некоторых кетокислот
- •15. Оксикислоты
- •Физические свойства некоторых оксикислот
- •16. ,-Непредельные карбонильные соединения
- •17. Аминокислоты
- •17.1. Кофигурация аминокислот
- •17.2. Кислотно-основные свойства
- •Аминокислоты
- •17.3. Способы получения
- •О г л а в л е н и е
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
1.2.2. Реакция с участием связи r–oh
Электроотрицательный
кислород, оттягивая общую пару электронов
связи
![]() ,
создает частичный положительный заряд
на углероде и этот атом углерода может
подвергаться атаке нуклеофила:
,
создает частичный положительный заряд
на углероде и этот атом углерода может
подвергаться атаке нуклеофила:
![]() .
.
Образование алкилгалогенидов. Спирты легко реагируют с галогеноводородами (HCl, HBr, HI). Реакционная способность падает в ряду НI > HBr > HCl.
![]()
Сухой газообразный галогеноводород пропускают в спирт или спирт нагревают с концентрированным раствором галогеноводорода. Реакция катализируется кислотами. Спирт, присоединяя протон, превращается в ион алкилоксония, который гораздо легче отщепляет нейтральную молекулу воды (“хорошая” уходящая группа), чем спирт – ион ОН (“плохая” уходящая группа).

Метиловый и первичные спирты реагируют по механизму SN2.
![]()
Механизм:
сначала происходит протонирование
спирта
![]() ,
а затем атака нуклеофилом Br
атома углерода
с образованием переходного состояния
и последующее отщепление молекулы воды:
,
а затем атака нуклеофилом Br
атома углерода
с образованием переходного состояния
и последующее отщепление молекулы воды:
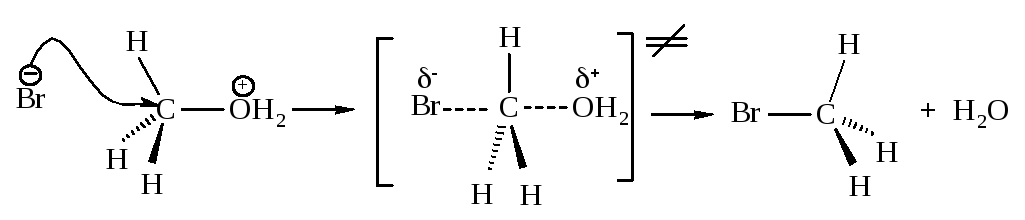
Вторичные и третичные спирты взаимодействуют с галогеноводородами по механизму SN1.

Механизм:
![]()
1 стадия,
медленная:
![]()
2 стадия, быстрая:
![]()
Поскольку реакции замещения у вторичных и третичных спиртов протекают через стадию образования карбониевого иона, возможна перегруппировка.

Механизм перегруппировки:

Реакционная способность спиртов по отношению к галогенводородам изменяется следующим образом:
Бензиловый, аллиловый > третичный > вторичный > первичный < метанол
![]()
SN1 SN2
|
Устойчивость карбокатионов возрастает, реакционная способность увеличивается |
Пространственные препятствия для атаки реакционного центра уменьшаются, реакционная способность увеличивается |
Реакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3, тионилхлоридом SOCl2. Для получения алкилгалогенидов используют реакции спиртов с галогенидами фосфора и тионилхлоридом, они не сопровождаются перегруппировками.



Механизм реакции спирта с тионилхлоридом. Взаимодействие одного моля спирта с одним молем тионилхлорида приводит к нестойкому алкилхлорсульфиту.

В присутствии основания, обычно пиридина, происходит инверсия путем атаки хлорид-иона на хлорсульфит.


Однако при проведении синтеза в эфире в отсутствии основания создаются условия для сохранения конфигурации. Частица ОSOCl вытесняется из хлорсульфита и при этом создается тесная ионная пара, в которой атом хлора с фронта (со стороны уходящей группы) атакует углеродный атом.

Такой тип реакций называют внутримолекулярным (интрамолекулярным) замещением и обозначают символом SNi.
Образование простых эфиров – межмолекулярная дегидратация. Межмолекулярная дегидратация спиртов служит примером нуклеофильного замещения, в котором субстратом является протонированная молекула спирта, а другая молекула ROH служит нуклеофилом.
Первичные спирты реагируют по механизму SN2
![]()
Механизм:
Протонирование
спирта:
![]()
Протонированный спирт подвергается атаке нуклеофилом

Применение этой реакции ограничено получением симметричных эфиров, т.к. при использовании различных спиртов получается смесь трех эфиров.
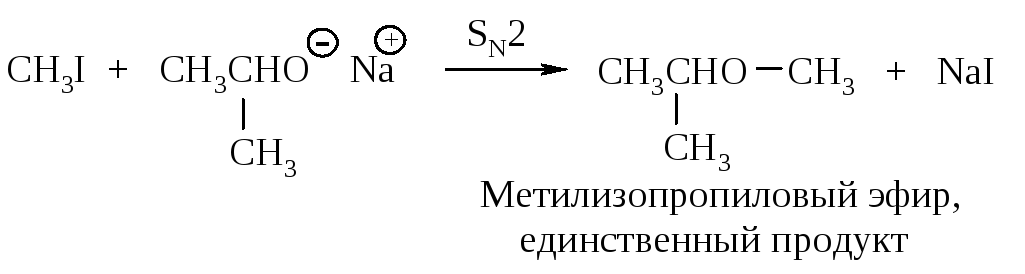
Важным методом получения простых эфиров является реакция алкоксидов с алкилгалогенидами (синтез Вильямсона) или алкилсульфатами ROSO2OR.

Бόльшая нуклеофильность алкоксидиона RО по сравнению со спиртом ROH означает бόльшую склонность к тому, чтобы выступать в качестве основания в реакции элиминирования. Поэтому при получении смешанных эфиров ROR1 следует учитывать возможность протекания конкурирующих реакций: нуклеофильного замещения и элиминирования. Например, для получения метилизопропилового эфира следует использовать йодистый метил и изопропилоксид натрия (пример 1), а не изопропилиодид и метоксид натрия (пример 2).
Пример 1:
Пример 2:
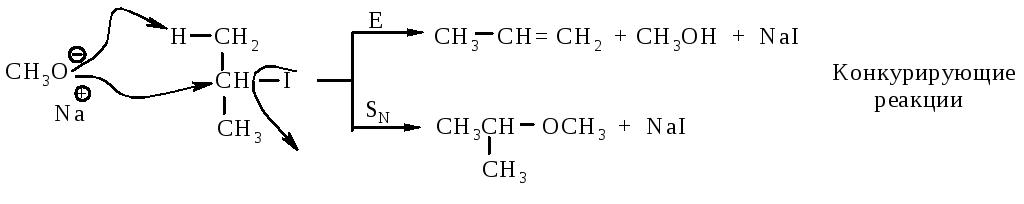
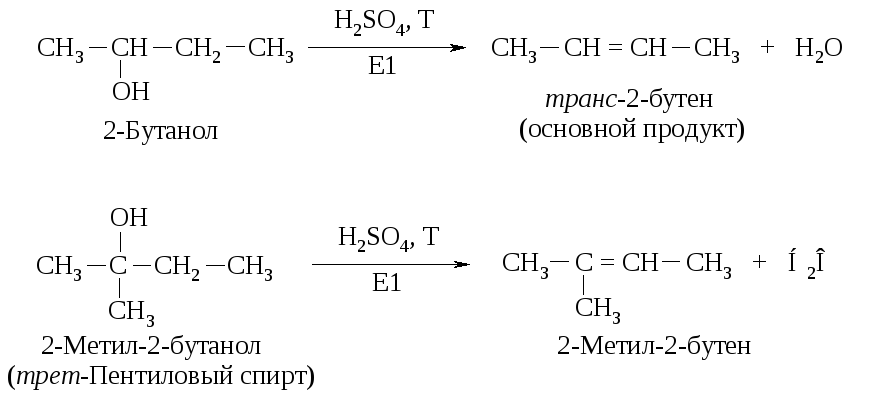
Вторичные и третичные спирты не подвергаются межмолекулярной дегидратации, а реагируют с образованием продуктов внутримолекулярной дегидратации - алкенов.
Образование
алкенов – внутримолекулярная дегидратация.
Под влиянием электроотрицательного
кислорода на связанном с кислородом
атоме углерода появляется положительный
заряд, это вызывает поляризацию
связи углерод-углерод и далее связи
 .
В определенных
условиях водород при Сβ
способен
отщепляться в виде протона, происходит
реакция элиминирования
.
В определенных
условиях водород при Сβ
способен
отщепляться в виде протона, происходит
реакция элиминирования
![]()
Спирт превращается в алкен при температуре ~ 200 оС в присутствии серной или фосфорной кислоты, либо при пропускании паров спирта над окисью алюминия (Al2O3 - кислота Льюиса) при температуре 300-350 оС.
Механизм дегидратации Е1:
Первая стадия, медленная – диссоциация протонированного спирта с образованием карбониевого иона.

Вторая стадия, быстрая: карбокатион теряет протон и образует алкен.
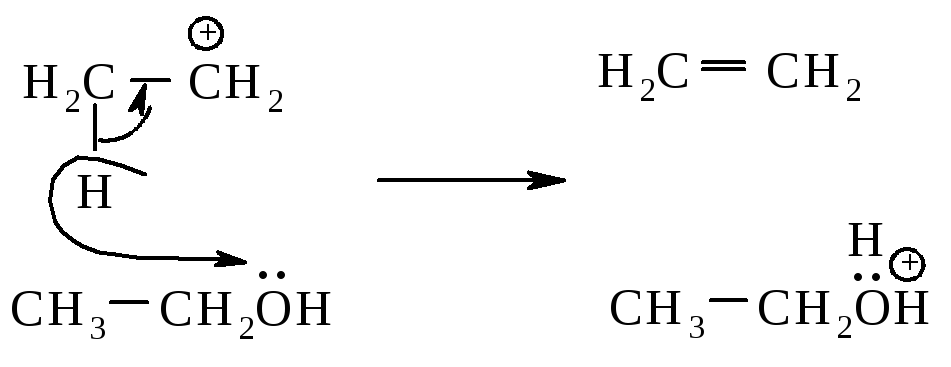
В отличие от галогеналканов, которые подвергаются элиминированию в основном по механизму Е2, спирты реагируют только по механизму Е1. Элиминирование Е2 требует присутствия сильного основания для отщепления протона, но кислая среда, необходимая для протонирования спирта, и сильное основание не совместимы.
Направление элиминирования. Элиминирование спиртов происходит с образованием более устойчивого, т.е. более алкилированного алкена (правило Зайцева).

Перегруппировка. Поскольку реакция Е1 протекает через стадию образования карбокатиона, она может сопровождаться перегруппировкой:
![]()

