
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
- •Удк 547
- •Удк 547
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •1. Спирты
- •1.1. Физические свойства
- •Сравнение физических свойств спиртов и углеводородов
- •1.2. Химические свойства
- •1.2.1. Реакции с участием связи o−h
- •1.2.2. Реакция с участием связи r–oh
- •1.2.3. Окисление, дегидрирование
- •1.3. Способы получения
- •1.3.1. Гидратация алкенов
- •1.3.2. Гидролиз галогеналканов
- •1.3.3. Синтез с помощью реактива Гриньяра
- •1.3.4. Гидроборирование-окисление алкенов
- •1.3.5. Восстановление карбонильных соединений
- •1.3.6. Брожение сахаров
- •2. Фенолы
- •2.1. Физические свойства
- •Физические свойства фенолов
- •2.2. Химические свойства
- •2.2.1. Кислотность
- •2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
- •2.2.3. Электрофильное замещение в ядре
- •2.2.4. Замещение гидроксигруппы в нитрофенолах
- •2.2.5. Окисление
- •2.2.6. Восстановление
- •3.3. Способы получения
- •4.1. Химические свойства
- •4.2. Способы получения
- •4.2.1. Превращение галогенгидринов под действием оснований
- •4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
- •5. Карбонильные соединения
- •5.1. Строение и физические свойства
- •5.2. Химические свойства
- •5.2.1. Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
- •5.2.2. Нуклеофильное присоединение - отщепление g–nh2 и спиртов
- •5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
- •Реакции, родственные альдольной конденсации
- •5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
- •5.2.5. Галогенирование кетонов - реакции с участием карбанионов
- •5.2.6. Взаимодействие альдегидов и кетонов с пентахлоридом фосфора
- •5.2.7. Восстановление
- •5.2.8. Окисление
- •5.3. Способы получения
- •Названия ацилов и ацилатов некоторых карбоновых кислот
- •6.1. Строение и физические свойства
- •6.2. Химические свойства
- •6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом о–н-связи. Кислотность
- •6.2.2. Реакции, сопровождающиеся разрывом связи с-он. Превращение в функциональные производные
- •6.2.3. Реакции замещения у -углеродного атома.
- •6.2.4. Восстановление кислот
- •7.1.2. Реакции замещения группы х у карбонильного атома углерода
- •7.1.3. Реакции сложного эфира по -углеродному атому
- •7.1.4. Восстановление производных кислот
- •8. Жиры. Воски
- •9. СульфОновые кислоты
- •9.1. Химические свойства
- •9.1.1. Кислотность. Образование солей
- •9.1.2. Превращение в производные кислот
- •Константы кислотности бензолсульфоновой и бензойной кислот и их амидов
- •9.1.3. Реакция замещения сульфогруппы
- •9.1.4. Электрофильное замещение в кольце – seAr
- •9.2. Способы получения
- •10. Дикарбоновые кислоты
- •10.1. Кислотные свойства
- •Физические свойства дикарбоновых кислот
- •10.2. Поведение при нагревании
- •10.3. Способы получения
- •11. Нитросоединения
- •11.1. Строение и физические свойства
- •Некоторые физические свойства нитрометана и ацетона
- •11.2. Химические свойства
- •11.3. Способы получения
- •12.2. Химические свойства
- •12.2.1. Основность
- •12.2.2. Реакции с участием аминогруппы
- •12.2.3. Замещение в кольце ароматических аминов
- •12.2.4. Реакции аминов с азотистой кислотой
- •12.3. Способы получения
- •12.3.1. Восстановление азотсодержащих соединений:
- •12.3.2. Взаимодействие галогенпроизводных с аммиаком или аминами
- •12.3.3. Взаимодействие спиртов с аммиаком или аминами
- •12.3.4. Восстановительное аминирование
- •12.3.5. Расщепление амидов по Гофману
- •13. Диазосоединения. Соли диазония
- •13.1. Свойства солей диазония
- •1. Синтез п-нитроанилинового красного.
- •2. Синтез метилоранжа
- •14. Кетокислоты
- •Физические свойства некоторых кетокислот
- •15. Оксикислоты
- •Физические свойства некоторых оксикислот
- •16. ,-Непредельные карбонильные соединения
- •17. Аминокислоты
- •17.1. Кофигурация аминокислот
- •17.2. Кислотно-основные свойства
- •Аминокислоты
- •17.3. Способы получения
- •О г л а в л е н и е
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
1. Синтез п-нитроанилинового красного.
Реакция диазотирования

Реакция азосочетания
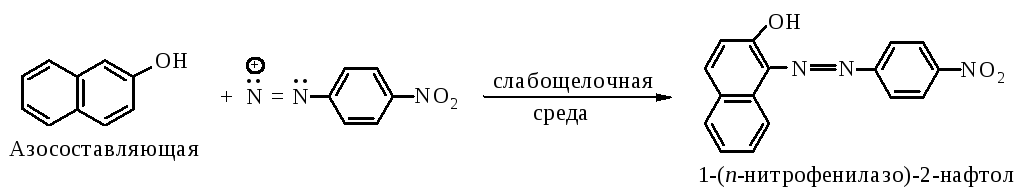
2. Синтез метилоранжа
Реакция диазотирования

Реакция азосочетания


Восстановление азосоединений. Щелочное восстановление азосоединения в мягких условиях превращает его в гидразосоединение.

Действием более сильных восстановителей азокраситель расщепляется по связи –N=N–. Эта реакция приводит к образованию двух аминов. Она очень полезна при определении структуры азосоединений.
![]()
14. Кетокислоты
Кетокислоты содержат функциональные группы кетона и карбоновой кислоты. Физические свойства некоторых кетокислот приведены в таблице 8.
Таблица 8
Физические свойства некоторых кетокислот
|
Название, формула |
Тпл., оС |
Ткип., оС |
Ка∙105 |
|
Пировиноградная СН3СОСООН |
14 |
165 (разл.) |
320 |
|
Ацетоуксусная СН3СОСН2СООН |
- |
100 (разл) |
22 |
|
Левулиновая СН3СОСН2СН2СООН |
31 |
245 |
2,3 |
Кетокислота ведет себя как кетон и как кислота. По карбонильной группе кетокислоты вступают в реакции нуклеофильного присоединения, гидрирования, по карбоксильной группе дают производные карбоновых кислот. Но кроме свойств индивидуальных функциональных групп, кетокислоты обладают особыми свойствами, которые обусловлены определенным взаимным расположением функциональных групп. К таким свойствам относится, например, повышенная кислотность -водородов в -кетокислотах; на этом свойстве основаны синтезы с помощью ацетоуксусного эфира.
Синтез кетонов и кислот с помощью ацетоуксусного эфира. В -кетокислотах -углеродный атом связан с двумя электроноакцепторными группами, вследствие этого -водород обладает значительно большей кислотностью по сравнению с кислотностью -водородного атома обычных эфиров.
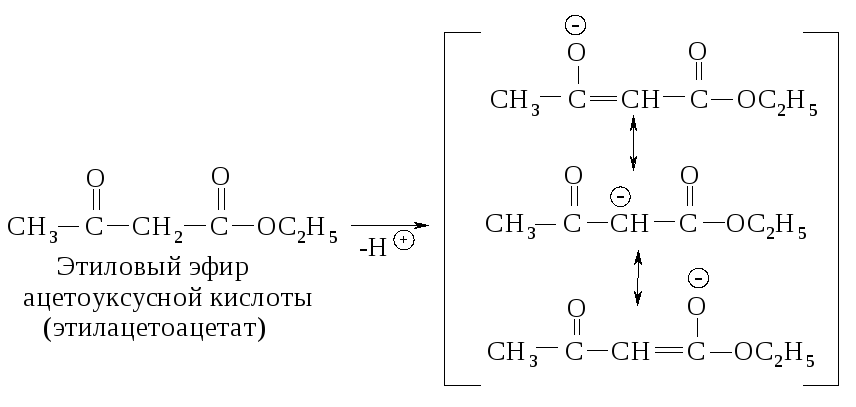
Образующийся анион обладает высокой устойчивостью (Ка -водорода в водном растворе составляет 10-11) вследствие того, что кислороды двух карбонильных групп участвуют в распределении отрицательного заряда.
Анионы сложных эфиров, подобных этилацетоацетату, могут быть проалкилированы. Эти реакции имеют важное значение для синтеза кетонов и карбоновых кислот.
Ацетоуксусный эфир (I) действием этоксида натрия превращается в натрацетоуксусный эфир (II), который вводится в реакцию с алкилгалогенидом. Удовлетворительные результаты достигаются при использовании первичных галогеналканов. Продукт моноалкилирования – моноалкилацетоуксусный эфир (III), содержит еще один кислый водород, который также может отщепляться под действием основания, а полученный анион может снова алкилироваться. При этом образуется диалкилацетоуксусный эфир (IV). Все реакции проводятся в абсолютном этиловом спирте.
При гидролизе разбавленным водным раствором кислоты моно- или диалкилацетоуксусные эфиры превращаются в кислоты, которые при нагревании легко декарбоксилируются, в результате образуются метилалкилкетоны (V, VI).
Под действием концентрированной щелочи происходит реакция, обратная конденсации Кляйзена (см. п. 7.1.3), и моно- или диалкилацетоуксусные эфиры расщепляются с образованием уксусной кислоты и моно- или диалкилзамещенных уксусных кислот (VII, VIII).


Получение ацетоуксусного эфира описано в п. 7.1.3.
