
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
- •Удк 547
- •Удк 547
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •1. Спирты
- •1.1. Физические свойства
- •Сравнение физических свойств спиртов и углеводородов
- •1.2. Химические свойства
- •1.2.1. Реакции с участием связи o−h
- •1.2.2. Реакция с участием связи r–oh
- •1.2.3. Окисление, дегидрирование
- •1.3. Способы получения
- •1.3.1. Гидратация алкенов
- •1.3.2. Гидролиз галогеналканов
- •1.3.3. Синтез с помощью реактива Гриньяра
- •1.3.4. Гидроборирование-окисление алкенов
- •1.3.5. Восстановление карбонильных соединений
- •1.3.6. Брожение сахаров
- •2. Фенолы
- •2.1. Физические свойства
- •Физические свойства фенолов
- •2.2. Химические свойства
- •2.2.1. Кислотность
- •2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
- •2.2.3. Электрофильное замещение в ядре
- •2.2.4. Замещение гидроксигруппы в нитрофенолах
- •2.2.5. Окисление
- •2.2.6. Восстановление
- •3.3. Способы получения
- •4.1. Химические свойства
- •4.2. Способы получения
- •4.2.1. Превращение галогенгидринов под действием оснований
- •4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
- •5. Карбонильные соединения
- •5.1. Строение и физические свойства
- •5.2. Химические свойства
- •5.2.1. Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
- •5.2.2. Нуклеофильное присоединение - отщепление g–nh2 и спиртов
- •5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
- •Реакции, родственные альдольной конденсации
- •5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
- •5.2.5. Галогенирование кетонов - реакции с участием карбанионов
- •5.2.6. Взаимодействие альдегидов и кетонов с пентахлоридом фосфора
- •5.2.7. Восстановление
- •5.2.8. Окисление
- •5.3. Способы получения
- •Названия ацилов и ацилатов некоторых карбоновых кислот
- •6.1. Строение и физические свойства
- •6.2. Химические свойства
- •6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом о–н-связи. Кислотность
- •6.2.2. Реакции, сопровождающиеся разрывом связи с-он. Превращение в функциональные производные
- •6.2.3. Реакции замещения у -углеродного атома.
- •6.2.4. Восстановление кислот
- •7.1.2. Реакции замещения группы х у карбонильного атома углерода
- •7.1.3. Реакции сложного эфира по -углеродному атому
- •7.1.4. Восстановление производных кислот
- •8. Жиры. Воски
- •9. СульфОновые кислоты
- •9.1. Химические свойства
- •9.1.1. Кислотность. Образование солей
- •9.1.2. Превращение в производные кислот
- •Константы кислотности бензолсульфоновой и бензойной кислот и их амидов
- •9.1.3. Реакция замещения сульфогруппы
- •9.1.4. Электрофильное замещение в кольце – seAr
- •9.2. Способы получения
- •10. Дикарбоновые кислоты
- •10.1. Кислотные свойства
- •Физические свойства дикарбоновых кислот
- •10.2. Поведение при нагревании
- •10.3. Способы получения
- •11. Нитросоединения
- •11.1. Строение и физические свойства
- •Некоторые физические свойства нитрометана и ацетона
- •11.2. Химические свойства
- •11.3. Способы получения
- •12.2. Химические свойства
- •12.2.1. Основность
- •12.2.2. Реакции с участием аминогруппы
- •12.2.3. Замещение в кольце ароматических аминов
- •12.2.4. Реакции аминов с азотистой кислотой
- •12.3. Способы получения
- •12.3.1. Восстановление азотсодержащих соединений:
- •12.3.2. Взаимодействие галогенпроизводных с аммиаком или аминами
- •12.3.3. Взаимодействие спиртов с аммиаком или аминами
- •12.3.4. Восстановительное аминирование
- •12.3.5. Расщепление амидов по Гофману
- •13. Диазосоединения. Соли диазония
- •13.1. Свойства солей диазония
- •1. Синтез п-нитроанилинового красного.
- •2. Синтез метилоранжа
- •14. Кетокислоты
- •Физические свойства некоторых кетокислот
- •15. Оксикислоты
- •Физические свойства некоторых оксикислот
- •16. ,-Непредельные карбонильные соединения
- •17. Аминокислоты
- •17.1. Кофигурация аминокислот
- •17.2. Кислотно-основные свойства
- •Аминокислоты
- •17.3. Способы получения
- •О г л а в л е н и е
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
13.1. Свойства солей диазония
Реакции солей диазония с выделением азота. Соли диазония ценны в синтезе не только потому, что они способны давать большое число соединений, но и потому, что их можно получать почти из всех первичных ароматических аминов, которые получают восстановлением нитросоединений, а они в свою очередь могут быть получены из углеводородов прямым нитрованием.

Реакции замещения на галоген. Замещение диазогруппы на хлор и бром осуществляют, смешивая свежеприготовленный раствор соли диазония с хлоридом или бромидом одновалентной меди в присутствии соответствующей галогеноводородной кислоты. Эти реакции с использованием Сu называются реакциями Зандмейера. Аналогична ей реакция Гаттермана с той лишь разницей, что в этом случае вместо галогенида меди (I) берут металлическую медь и галогеноводородную кислоту.
![]()
![]()
Замещение диазогруппы на I не требует применения меди Сu или порошка меди, достаточно подействовать на соль диазония иодидом калия.
![]()
Замещение на -CN. Реакция Зандмейера применяется также для синтеза ароматических нитрилов, которые гидролизом могут быть превращены в кислоты.

Таким образом, нитросоединения можно превращать в карбоновые кислоты.
Замещение на -ОН
![]()
Эта реакция медленно протекает даже в ледяном растворе, и это является причиной, по которой соли диазония надо использовать сразу после их приготовления. При повышенной температуре эта реакция становится главной.
Замещение на –Н. Соль диазония, оставленная стоять в присутствии восстановителя (чаще всего фосфорноватистая кислота Н3РО2), превращается в углеводород.
![]()
С помощью этой реакции можно удалять из кольца группу - NH2.
Замещение на -NО2. На соль диазония действуют нитритом натрия и солью одновалентной меди Cu+ (реакция Зандмейера).
![]()
Реакции солей диазония без выделения азота. Азосочетание
Соли диазония в определенных условиях реагируют с некоторыми ароматическими соединениями с образованием азосоединений Ar–N=N–Ar, в которых группа – N2 – соединена с двумя углеводородными радикалами. Эти реакции называются реакциями азосочетания.

Замещение обычно протекает в п-положение, если оно занято, сочетание происходит в о-положение.
Механизм реакции – электрофильное замещение SEAr. Электрофильным агентом является ион диазония, очень слабый электрофил.
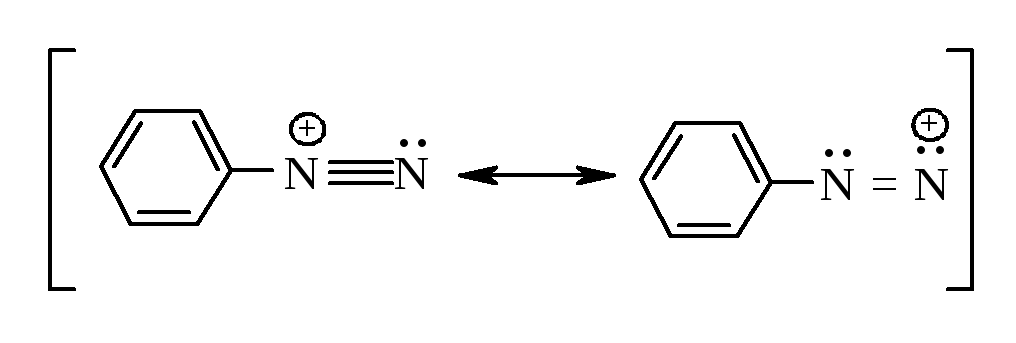
Такой слабый электрофил атакует только очень реакционноспособные кольца, содержащие сильные электронодонорные группы G.
![]()
Сочетание с фенолами ведется в слабощелочной среде, при пониженной температуре. Фенол обладает заметно кислыми свойствами, в водном растворе он существует в равновесии с феноксид-ионом.

Наличие полного отрицательного заряда делает заместитель бóльшим донором электронов. Чем больше щелочность среды, тем выше содержание феноксид-иона, тем выше скорость азосочетания. С другой стороны, в присутствии ОН ион диазония существует в равновесии с неионизированным соединением. Это значит, что реакции азосочетания будет благоприятствовать низкая концентрация гидроксид-иона, т.е. кислая среда.
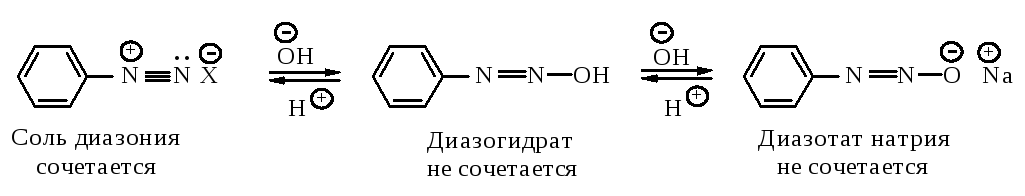
Условия, при которых протекает реакция сочетания с фенолами, являются компромиссными: раствор должен быть настолько слабо щелочным, чтобы концентрация диазотат-иона не стала слишком высокой, и настолько сильно щелочным, чтобы концентрация феноксид-иона была достаточной для успешного протекания реакции, т.е. поддерживается слабощелочная среда.
Сочетание с аминами. Высокая кислотность среды способствует тому, что диазосоединение полностью находится в виде диазокатиона. Но чем выше кислотность, тем выше доля амина в виде иона аммония, который не активен в реакциях электрофильного замещения. Поэтому среда должна быть слабокислой, чтобы достаточное количество амина было в свободном состоянии.

Примеры:
