
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
- •Удк 547
- •Удк 547
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •1. Спирты
- •1.1. Физические свойства
- •Сравнение физических свойств спиртов и углеводородов
- •1.2. Химические свойства
- •1.2.1. Реакции с участием связи o−h
- •1.2.2. Реакция с участием связи r–oh
- •1.2.3. Окисление, дегидрирование
- •1.3. Способы получения
- •1.3.1. Гидратация алкенов
- •1.3.2. Гидролиз галогеналканов
- •1.3.3. Синтез с помощью реактива Гриньяра
- •1.3.4. Гидроборирование-окисление алкенов
- •1.3.5. Восстановление карбонильных соединений
- •1.3.6. Брожение сахаров
- •2. Фенолы
- •2.1. Физические свойства
- •Физические свойства фенолов
- •2.2. Химические свойства
- •2.2.1. Кислотность
- •2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
- •2.2.3. Электрофильное замещение в ядре
- •2.2.4. Замещение гидроксигруппы в нитрофенолах
- •2.2.5. Окисление
- •2.2.6. Восстановление
- •3.3. Способы получения
- •4.1. Химические свойства
- •4.2. Способы получения
- •4.2.1. Превращение галогенгидринов под действием оснований
- •4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
- •5. Карбонильные соединения
- •5.1. Строение и физические свойства
- •5.2. Химические свойства
- •5.2.1. Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
- •5.2.2. Нуклеофильное присоединение - отщепление g–nh2 и спиртов
- •5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
- •Реакции, родственные альдольной конденсации
- •5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
- •5.2.5. Галогенирование кетонов - реакции с участием карбанионов
- •5.2.6. Взаимодействие альдегидов и кетонов с пентахлоридом фосфора
- •5.2.7. Восстановление
- •5.2.8. Окисление
- •5.3. Способы получения
- •Названия ацилов и ацилатов некоторых карбоновых кислот
- •6.1. Строение и физические свойства
- •6.2. Химические свойства
- •6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом о–н-связи. Кислотность
- •6.2.2. Реакции, сопровождающиеся разрывом связи с-он. Превращение в функциональные производные
- •6.2.3. Реакции замещения у -углеродного атома.
- •6.2.4. Восстановление кислот
- •7.1.2. Реакции замещения группы х у карбонильного атома углерода
- •7.1.3. Реакции сложного эфира по -углеродному атому
- •7.1.4. Восстановление производных кислот
- •8. Жиры. Воски
- •9. СульфОновые кислоты
- •9.1. Химические свойства
- •9.1.1. Кислотность. Образование солей
- •9.1.2. Превращение в производные кислот
- •Константы кислотности бензолсульфоновой и бензойной кислот и их амидов
- •9.1.3. Реакция замещения сульфогруппы
- •9.1.4. Электрофильное замещение в кольце – seAr
- •9.2. Способы получения
- •10. Дикарбоновые кислоты
- •10.1. Кислотные свойства
- •Физические свойства дикарбоновых кислот
- •10.2. Поведение при нагревании
- •10.3. Способы получения
- •11. Нитросоединения
- •11.1. Строение и физические свойства
- •Некоторые физические свойства нитрометана и ацетона
- •11.2. Химические свойства
- •11.3. Способы получения
- •12.2. Химические свойства
- •12.2.1. Основность
- •12.2.2. Реакции с участием аминогруппы
- •12.2.3. Замещение в кольце ароматических аминов
- •12.2.4. Реакции аминов с азотистой кислотой
- •12.3. Способы получения
- •12.3.1. Восстановление азотсодержащих соединений:
- •12.3.2. Взаимодействие галогенпроизводных с аммиаком или аминами
- •12.3.3. Взаимодействие спиртов с аммиаком или аминами
- •12.3.4. Восстановительное аминирование
- •12.3.5. Расщепление амидов по Гофману
- •13. Диазосоединения. Соли диазония
- •13.1. Свойства солей диазония
- •1. Синтез п-нитроанилинового красного.
- •2. Синтез метилоранжа
- •14. Кетокислоты
- •Физические свойства некоторых кетокислот
- •15. Оксикислоты
- •Физические свойства некоторых оксикислот
- •16. ,-Непредельные карбонильные соединения
- •17. Аминокислоты
- •17.1. Кофигурация аминокислот
- •17.2. Кислотно-основные свойства
- •Аминокислоты
- •17.3. Способы получения
- •О г л а в л е н и е
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
10.3. Способы получения
Общие методы получения дикарбоновых кислот аналогичны способам получения монокарбоновых кислот.
Малоновую кислоту синтезируют из уксусной кислоты.
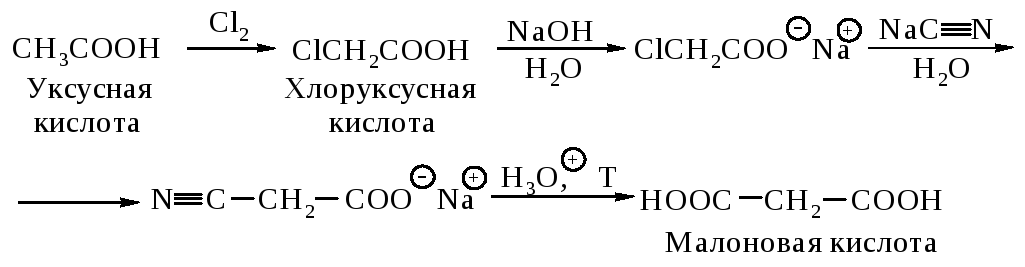
Янтарную и глутаровую кислоты можно получить через соответствующие динитрилы.

Янтарную кислоту получают также и по следующей схеме.

Глутаровая и адипиновая кислоты образуются окислением циклопентанона и циклогексанона соответственно. При этом в промышленности в
качестве окислителя применяют разбавленную азотную кислоту.
![]()
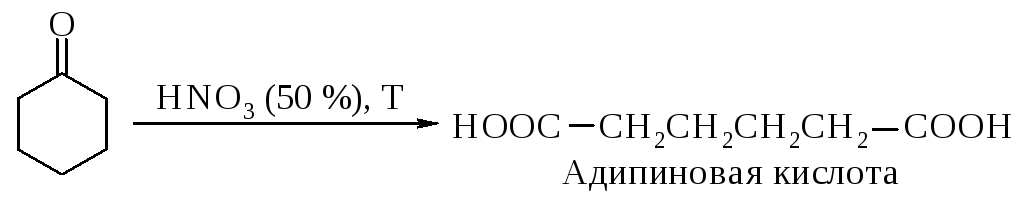
Щавелевую кислоту получают при нагревании формиата натрия.

Окисление соответствующих ксилолов дает фталевые кислоты. Терефталевую кислоту получают жидкофазным окислением п-ксилола, а фталевую – парофазным окислением о-ксилола или нафталина с последующим гидролизом фталевого ангидрида.


11. Нитросоединения
Нитросоединения R-NO2, Ar-NO2 – очень важный класс азотистых производных. Классификация нитросоединений производится в зависимости от углеродного фрагмента: нитроалканы, нитроциклоалканы и нитроарены, и от типа углеродного атома, связанного с группой –NO2: первичные, вторичные и третичные.
Название нитросоединения образуется от названия углеводорода с префиксом нитро-:

11.1. Строение и физические свойства
Нитрогруппа сильно полярна.

В каждой из граничных структур показана семиполярная связь – ковалентная донорно-акцепторная связь между азотом и кислородом, образованная за счет пары электронов только одного атома азота, вследствие чего оба атома получают заряды: атом кислорода, акцептор пары электронов – отрицательный, атом азота, донор пары электронов – положительный заряд.
![]()
Такое представление о строении нитросоединений согласуется с высокими значениями дипольных моментов нитросоединений (11,7-13,3)·10-30 Кл·м. Полярный характер нитросоединений приводит к меньшей летучести по сравнению с соединениями с близкой молекулярной массой.
Несколько неожиданной является низкая растворимость нитрометана в воде – 10 г в 100 мл, а ацетон смешивается с водой во всех отношениях (табл. 7.).
Таблица 7
Некоторые физические свойства нитрометана и ацетона
|
Соединение |
Молекулярная масса |
Температура кипения, оС |
Растворимость в 100 мл воды, г |
|
Нитрометан СН3NO2 |
61 |
101,2 |
9-10 |
|
Ацетон CH3COCH3 |
58 |
56,2 |
∞ |
Нитроалканы представляют собой бесцветные жидкости с высокими для их молекулярных масс температурами кипения. Температура кипения нитрометана 101,2 оС; нитроэтана – 114 оС. Они обладают приятным запахом, перегоняются без разложения, мало растворимы в воде, ядовиты. Нитроалкены и нитроарены – жидкие или твердые вещества желтого цвета. Они тяжелее воды и не растворимы в ней. Эти нитросоединения имеют острый запах и высокотоксичны, особенно нитробензол.
11.2. Химические свойства
Термодинамическая неустойчивость нитросоединений. Молярная теплота разложения нитрометана около 270 кДж/моль.
СН3NO2→ 1/2 N2 + CO2 + 3/2 H2
Значительная энергия и большая скорость такого процесса послужили основой для практического применения нитросоединений в качестве взрывчатых веществ.
Восстановление нитросоединений до аминов – наиболее важная реакция для синтеза азотсодержащих соединений.
Нитроалканы восстанавливают до алкиламинов оловом или железом в кислой среде, водородом в условиях гетерогенного катализа.
![]() ∆Н=
-356 кДж/моль
∆Н=
-356 кДж/моль
Реакция восстановления нитроаренов протекает гладко при действии олова или железа в соляной кислоте, а также водорода Н2 (Ni), гидросульфидов металлов, цинка в щелочной среде.
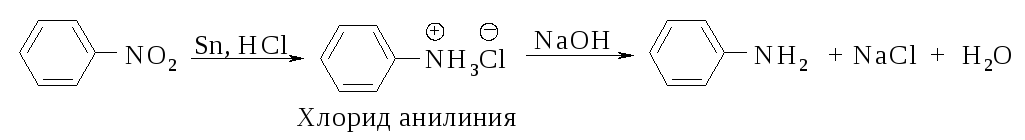
![]()

Реакция гидрирования очень экзотермична.
В нейтральном или щелочном растворе активность восстанавливающих агентов по отношению к нитробензолу меньше, чем в кислом растворе. Восстановление в присутствии щелочи идет через следующие стадии:

В зависимости от условий восстановление можно остановить на одной из стадий. Например, восстановление цинком в водном растворе хлористого аммония дает фенилгидроксиламин, а при действии цинка в водно-спиртовом растворе гидроксида натрия анилин превращается в гидразобензол.
Гидразобензол
![]() в
сильнокислой среде претерпевает
необычную перегруппировку, приводящую
к образованию бензидина – очень важного
промежуточного продукта в синтезе
красителей. Скорость перегруппировки
пропорциональна квадрату концентрации
протона.
в
сильнокислой среде претерпевает
необычную перегруппировку, приводящую
к образованию бензидина – очень важного
промежуточного продукта в синтезе
красителей. Скорость перегруппировки
пропорциональна квадрату концентрации
протона.


Реакции с участием -водородных атомов - наиболее важные реакции нитроалканов.
Нитрометан обладает настолько сильными кислотными свойствами, что способен растворяться в едком натре.

Интересной особенностью этой соли является то, что при подкислении ее растворов образуется неустойчивый и обладающий очень сильными кислыми свойствами изомер нитрометана – ациформа, которая медленно превращается в нитрометан.


Первичные и вторичные нитросоединения вступают с карбонильными соединениями в реакции типа альдольной конденсации.
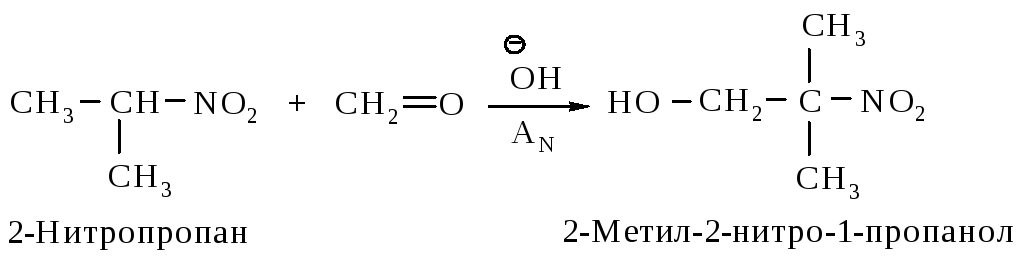
Механизм:
Образование под влиянием основания карбаниона (I) – устойчивого сопряженного основания.

Далее происходит взаимодействие муравьиного альдегида с нуклеофилом (I) и образование промежуточного продукта (II).

Стабилизация промежуточного продукта (II) осуществляется за счет переноса протона от более слабого основания – гидроксид-иона к более сильному.

