
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
- •Удк 547
- •Удк 547
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •1. Спирты
- •1.1. Физические свойства
- •Сравнение физических свойств спиртов и углеводородов
- •1.2. Химические свойства
- •1.2.1. Реакции с участием связи o−h
- •1.2.2. Реакция с участием связи r–oh
- •1.2.3. Окисление, дегидрирование
- •1.3. Способы получения
- •1.3.1. Гидратация алкенов
- •1.3.2. Гидролиз галогеналканов
- •1.3.3. Синтез с помощью реактива Гриньяра
- •1.3.4. Гидроборирование-окисление алкенов
- •1.3.5. Восстановление карбонильных соединений
- •1.3.6. Брожение сахаров
- •2. Фенолы
- •2.1. Физические свойства
- •Физические свойства фенолов
- •2.2. Химические свойства
- •2.2.1. Кислотность
- •2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
- •2.2.3. Электрофильное замещение в ядре
- •2.2.4. Замещение гидроксигруппы в нитрофенолах
- •2.2.5. Окисление
- •2.2.6. Восстановление
- •3.3. Способы получения
- •4.1. Химические свойства
- •4.2. Способы получения
- •4.2.1. Превращение галогенгидринов под действием оснований
- •4.2.2. Окисление алкенов гидропероксидами (реакция Прилежаева)
- •5. Карбонильные соединения
- •5.1. Строение и физические свойства
- •5.2. Химические свойства
- •5.2.1. Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
- •5.2.2. Нуклеофильное присоединение - отщепление g–nh2 и спиртов
- •5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
- •Реакции, родственные альдольной конденсации
- •5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
- •5.2.5. Галогенирование кетонов - реакции с участием карбанионов
- •5.2.6. Взаимодействие альдегидов и кетонов с пентахлоридом фосфора
- •5.2.7. Восстановление
- •5.2.8. Окисление
- •5.3. Способы получения
- •Названия ацилов и ацилатов некоторых карбоновых кислот
- •6.1. Строение и физические свойства
- •6.2. Химические свойства
- •6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом о–н-связи. Кислотность
- •6.2.2. Реакции, сопровождающиеся разрывом связи с-он. Превращение в функциональные производные
- •6.2.3. Реакции замещения у -углеродного атома.
- •6.2.4. Восстановление кислот
- •7.1.2. Реакции замещения группы х у карбонильного атома углерода
- •7.1.3. Реакции сложного эфира по -углеродному атому
- •7.1.4. Восстановление производных кислот
- •8. Жиры. Воски
- •9. СульфОновые кислоты
- •9.1. Химические свойства
- •9.1.1. Кислотность. Образование солей
- •9.1.2. Превращение в производные кислот
- •Константы кислотности бензолсульфоновой и бензойной кислот и их амидов
- •9.1.3. Реакция замещения сульфогруппы
- •9.1.4. Электрофильное замещение в кольце – seAr
- •9.2. Способы получения
- •10. Дикарбоновые кислоты
- •10.1. Кислотные свойства
- •Физические свойства дикарбоновых кислот
- •10.2. Поведение при нагревании
- •10.3. Способы получения
- •11. Нитросоединения
- •11.1. Строение и физические свойства
- •Некоторые физические свойства нитрометана и ацетона
- •11.2. Химические свойства
- •11.3. Способы получения
- •12.2. Химические свойства
- •12.2.1. Основность
- •12.2.2. Реакции с участием аминогруппы
- •12.2.3. Замещение в кольце ароматических аминов
- •12.2.4. Реакции аминов с азотистой кислотой
- •12.3. Способы получения
- •12.3.1. Восстановление азотсодержащих соединений:
- •12.3.2. Взаимодействие галогенпроизводных с аммиаком или аминами
- •12.3.3. Взаимодействие спиртов с аммиаком или аминами
- •12.3.4. Восстановительное аминирование
- •12.3.5. Расщепление амидов по Гофману
- •13. Диазосоединения. Соли диазония
- •13.1. Свойства солей диазония
- •1. Синтез п-нитроанилинового красного.
- •2. Синтез метилоранжа
- •14. Кетокислоты
- •Физические свойства некоторых кетокислот
- •15. Оксикислоты
- •Физические свойства некоторых оксикислот
- •16. ,-Непредельные карбонильные соединения
- •17. Аминокислоты
- •17.1. Кофигурация аминокислот
- •17.2. Кислотно-основные свойства
- •Аминокислоты
- •17.3. Способы получения
- •О г л а в л е н и е
- •И.С. Колпащикова, а.Ф. Бетнев, е.М. Алов функциональные производные углеводородов
6.2.3. Реакции замещения у -углеродного атома.
Реакция Гелля-Фольгарда-Зелинского
Карбоновые кислоты реагируют с бромом или хлором в присутствии небольших количеств фосфора с образованием -галогензамещенных кислот.
![]()
Реакция состоит во взаимодействии первоначально образующегося бромангидрида с бромом.
![]()



Эта реакция по механизму аналогична реакции кислотно-каталитического галогенирования кетонов. Для этой реакции необходимы только каталитические количества PBr3, поскольку образовавшийся бромангидрид -бромпропионовой кислоты, взаимодействуя с исходной пропионовой кислотой, превращается в -бромпропионовую кислоту, регенерируя при этом бромангидрид пропионовой кислоты.

Галоген в этих кислотах так же, как в галогеналканах, замещается при действии нуклеофильных реагентов CN, HO, NH3, I или отщепляется при действии спиртового раствора щелочи (рис. 3.).
6.2.4. Восстановление кислот
Карбоновые кислоты восстанавливаются до спиртов действием литийалюминийгидрида.
![]()
6.2.5. Декарбоксилирование кислот
Декарбоксилирование кислот происходит при сплавлении с натронной известью.

Для ароматических кислот:
![]()
Электролиз солей карбоновых кислот (синтез Кольбе) также происходит с отщеплением диоксида углерода.

6.2.6. Замещение в ароматическом ядре
Электроноакцепторная карбоксильная группа, проявляющая эффекты -I, -M, дезактивирует ароматическое кольцо в реакциях электрофильного замещения.

6.3. Способы получения
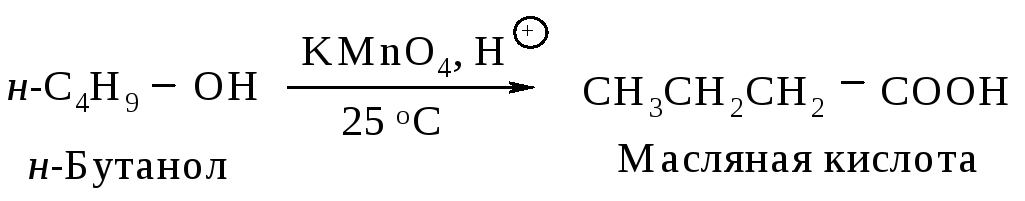
6.3.1. Окисление первичных спиртов
При нагревании первичных спиртов с водным раствором перманганата калия получают карбоновые кислоты
6.3.2. Окисление алкилбензолов
Это один из наиболее часто применяемых способов получения ароматических кислот. Окисление проводят либо при кипячении углеводорода с перманганатом калия, либо кислородом воздуха в присутствии катализаторов окисления.

6.3.3. Гидролиз нитрилов
Реакцию гидролиза производных карбоновых кислот часто применяют в лабораторной практике. Нитрилы гидролизуют при нагревании (как правило, при кипячении) с водными растворами минеральных кислот (реже – щелочей).

6.3.4. Гидролиз тригалогенпроизводных
Гидролиз тригалогенпроизводных для получения карбоновых кислот применяют реже. При этом используют те же условия, что и при гидролизе нитрилов и сложных эфиров.

6.3.5. Карбоксилирование реактива Гриньяра
Карбоксилирование реактива Гриньяра служит одним из универсальных способов получения карбоновых кислот.

Этот метод имеет, однако, ограничение. Алкил- и арилгалогениды, применяемые в реакциях, не должны содержать заместители (–ОН, –NH2, –SH, –C=О), которые активно реагируют с реактивам Гриньяра.
7. Функциональные производные карбоновых кислот
Функциональными
производными карбоновых кислот
![]() являются
соединения, образующиеся при замещении
гидроксильной группы –ОН на другую
группу Х и вновь превращающиеся при
гидролизе в
карбоновые
кислоты.
являются
соединения, образующиеся при замещении
гидроксильной группы –ОН на другую
группу Х и вновь превращающиеся при
гидролизе в
карбоновые
кислоты.

Ацильная группа является общим элементом функциональных производных карбоновых кислот. К производным карбоновых кислот относятся и нитрилы RCN, так как при гидролизе они также превращаются в кислоты.
7.1. Химические свойства
7.1.1. Реакционная способность
Ацильные соединения, т.е. карбоновые кислоты и их функциональные производные, вступают в реакции нуклеофильного замещения групп Х: –ОН, –Сl, –OCOR, –OR, NH2.
![]()
Первая
стадия нуклеофильной атаки по карбонильному
углероду одинакова для альдегидов,
кетонов и ацильных соединений –
образование продукта присоединения по
двойной связи. Как и в случае альдегидов
и кетонов, пространственные и электронные
факторы делают карбонильную группу
доступной для атаки нуклеофильным
реагентом: а) атака нуклеофила
по углероду плоской группы
![]() не
затруднена, тригональный углерод
относительно беспрепятственно
превращается в тетраэдрический
промежуточный продукт (III);
б) электроотрицательный кислород легко
приобретает и несет на себе отрицательный
заряд, возникающий в промежуточном
соединении; дальнейшее превращение
ионов (I) и (III)
различно: промежуточный продукт,
образующийся из альдегидов и кетонов
(I), присоединяя протон, дает продукт
присоединения (II), а промежуточный
продукт, образующийся из ацильного
производного (III), отщепляет группу Х, и
в результате образуется продукт замещения
(IV).
не
затруднена, тригональный углерод
относительно беспрепятственно
превращается в тетраэдрический
промежуточный продукт (III);
б) электроотрицательный кислород легко
приобретает и несет на себе отрицательный
заряд, возникающий в промежуточном
соединении; дальнейшее превращение
ионов (I) и (III)
различно: промежуточный продукт,
образующийся из альдегидов и кетонов
(I), присоединяя протон, дает продукт
присоединения (II), а промежуточный
продукт, образующийся из ацильного
производного (III), отщепляет группу Х, и
в результате образуется продукт замещения
(IV).

В случае ацильных соединений стабилизация промежуточного аниона происходит путем отщепления групп, которые являются слабыми основаниями Сl, RCOO или сравнительно сильными основаниями R1O, NH2. У альдегидов и кетонов во второй стадии реакции не происходит отщепления ионов Н или R, так как они являются самыми сильными основаниями и, следовательно, очень “плохими” уходящими группами, поэтому вместо отщепления Н или R происходит присоединение Н.
Таким
образом, нуклеофильное замещение в
ацильных производных происходит в две
стадии: 1) нуклеофильное присоединение
по двойной связи
![]() с
образованием промежуточного
тетраэдрического продукта;
2)
стабилизация последнего путем отщепления
группы Х
(уходящая группа). Способность
быть “хорошей” уходящей группой
соответственно уменьшается в ряду
с
образованием промежуточного
тетраэдрического продукта;
2)
стабилизация последнего путем отщепления
группы Х
(уходящая группа). Способность
быть “хорошей” уходящей группой
соответственно уменьшается в ряду

По легкости протекания второй стадии ацильные производные располагаются в следующий ряд:

Как и в реакциях альдегидов и кетонов, в случае слабого нуклеофила (Н2О, RОН) реакция катализируется кислотой: во-первых, протон Н делает карбонильную группу более доступной для нуклеофильной атаки (I), во-вторых, в этом случае образуется устойчивый незаряженный промежуточный продукт (II)


Хлорангидриды и ангидриды очень реакционноспособные соединения; даже со слабыми нуклеофилами они реагируют без катализатора. Например, хлористый ацетил бурно реагирует с водой, хлорангидриды ароматических кислот менее реакционноспособны.
