
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Отличительные особенности строения углеводсодержащих белков
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •2. Энзимы как биокатализаторы
- •2.1. Теории, объясняющие механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •2.2. Специфичность действия энзимов
- •2.3. Кинетика ферментативных реакций
- •2.3.1. Зависимость скорости реакции от содержания субстрата
- •2.3.2. Влияние концентрации фермента на скорость реакции
- •2.3.3. Эффект колебаний температуры
- •2.3.4. Связь интенсивности процесса с величинами рН среды
- •3. Классификация, номенклатура ферментов
- •3.1. Классификация
- •2.1.1. Характеристика отдельных классов ферментов
- •4. Положительная и отрицательная регуляции работы ферментов
- •4.1. Механизмы аллостерической регуляции
- •4.2. Последствия белок - белкового взаимодействия
- •4.3. Регуляция путём ковалентной модификации
- •4.4. Частичный протеолиз как способ активации зимогена
- •Особенности конкурентного ингибирования
- •5. Использование ферментов в медицине
- •5.1. Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •Приложение № 1
- •Варианты правильных ответов на контрольные тесты
- •Список литературы
Отличительные особенности строения углеводсодержащих белков
|
Гликопротеины |
Протеогликаны |
|
|
Как видно из таблицы
1, для собственно гликопротеинов
характерно
низкое содержание углеводов 15-20 %, которые
присоединены к амидному азоту аспарагина
N-гликозидной
связью, либо к гидроксигруппе остатка
серина, реже треонина, гидроксилизина.
В глициде отсутствует регулярность в
чередовании моносахаридов, регистрируются
манноза, галактоза, глюкоза, их
аминопроизводные, N-ацетилнейраминовая
кислота. Разнообразие гликановых
фрагментов используется при построении
мембранных рецепторов (рис. 15), для
обеспечения взаимодействия антиген-антитело,
с пецифичных
контактов клеток между собой, а также
в защите ферментов от протеолиза. Почти
все внеклеточные белки, включая глобулины
(см. 4.1.1.) крови, относятся к гликопротеинам.
К ним же принадлежат некоторые гормоны
(тиреотропный, гонадотропные) являются
гликоконъюгатами. К типичным представителям
данного класса белков относятся все
антитела (иммуноглобулины), интерфероны,
факторы системы комплемента, групп
крови и др. Первые — синтезируются в
плазмоцитах, обезвреживают антигены
любой химической природы. Различают
пять классов иммуноглобулинов: IgG, IgM,
IgA, IgD и IgE.Интерфероны
(α, β, γ) — гликопротеины, образующиеся
в клетке в ответ на внедрение вирусов
и ингибирующие их размножение.
пецифичных
контактов клеток между собой, а также
в защите ферментов от протеолиза. Почти
все внеклеточные белки, включая глобулины
(см. 4.1.1.) крови, относятся к гликопротеинам.
К ним же принадлежат некоторые гормоны
(тиреотропный, гонадотропные) являются
гликоконъюгатами. К типичным представителям
данного класса белков относятся все
антитела (иммуноглобулины), интерфероны,
факторы системы комплемента, групп
крови и др. Первые — синтезируются в
плазмоцитах, обезвреживают антигены
любой химической природы. Различают
пять классов иммуноглобулинов: IgG, IgM,
IgA, IgD и IgE.Интерфероны
(α, β, γ) — гликопротеины, образующиеся
в клетке в ответ на внедрение вирусов
и ингибирующие их размножение.
Другая группа
гликоконъюгатов – протеогликаны
– характеризуется наличием крупных
полисахаридов (рис. 16), в состав которых
входят гликозаминогликаны
(ГАГ): гиалуроновая кислота,
хондроитин-сульфаты, кератансульфаты,
дерматансульфаты и гепарансульфаты.
У глеводные
фрагменты усиливают гидрофильные
свойства белков за счёт большого
количества гидроксильных групп и
кислотных группировок. Соотношение
компонентов: протеина - 10-15%, а углеводов
- 90-95%. Цепи последних недостаточно гибкие
и стремятся принять конформацию очень
рыхлого случайного клубка, занимая
огромный объём. Будучи гидрофильными,
они притягивают много воды и даже в
низких концентрациях образуютгидратированные
гели. Подобная
способность создаёт во внеклеточном
пространстве тургор.
Протеогликаны хрящевого матрикса
содержат гиалуроновую
кислоту,
образующую студенистый гель, выполняющий
роль амортизатора в хрящах и суставных
поверхностях. Входя в межклеточное
вещество соединительной ткани она
регулирует её проницаемость.
глеводные
фрагменты усиливают гидрофильные
свойства белков за счёт большого
количества гидроксильных групп и
кислотных группировок. Соотношение
компонентов: протеина - 10-15%, а углеводов
- 90-95%. Цепи последних недостаточно гибкие
и стремятся принять конформацию очень
рыхлого случайного клубка, занимая
огромный объём. Будучи гидрофильными,
они притягивают много воды и даже в
низких концентрациях образуютгидратированные
гели. Подобная
способность создаёт во внеклеточном
пространстве тургор.
Протеогликаны хрящевого матрикса
содержат гиалуроновую
кислоту,
образующую студенистый гель, выполняющий
роль амортизатора в хрящах и суставных
поверхностях. Входя в межклеточное
вещество соединительной ткани она
регулирует её проницаемость.
Липопротеины – сложные белки, простетическая группа в которых – липиды: нейтральные жиры (ТАГ), эфиры холестерола, фосфолипиды (ФЛ). Между компонентами возникают гидрофобные взаимодействия, реже ионная или эфирная связи.
Все липопротеины имеют сходное строение (рис 17).
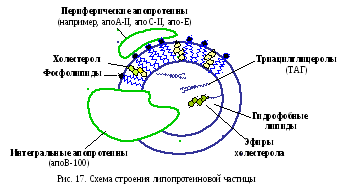
Внутри липопротеиновой частицы находится жировая капля – ядро, содержащее неполярные (гидрофобные) липиды: ТАГ и эфиры холестерола. Снаружи оно окружено однослойной мембраной, образованной ФЛ, белком и НЭХС. Белковый компонент получил название аполипопротеин(ы), некоторые из них прочно связаны со всеми фрагментами и не могут быть отделены от целой мицеллы, а другие способны переходить от одного липопротеина к другому. Их белки выполняют несколько функций: формируют структуру частицы, взаимодействуют с рецепторами на поверхности плазмоллем, определяя, каким тканям она необходима, служат ферментами или их активаторами.
Плотность белка выше плотности липидов, поэтому, чем меньше доля апопротеина в частице, тем она тяжелее. По соотношению входящих в частицу компонентов различают несколько классов липопротеинов: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП).
Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Благодаря наличию отрицательного заряда на поверхности ЛП хорошо растворимы в крови. Мицеллы небольших размеров способны легко проникать через стенки сосудов, а некоторым (ХМ) это делать трудно из-за больших размеров, поэтому они сначала попадают в лимфатические сосуды, затем через главный грудной проток вливаются в систему полых вен, правое предсердие, малый круг кровообращения и только потом оказываются в аорте и артериях, доставляющих их к органам.
Характеристика ЛП частиц представлена в таблице 2.
Таблица 2.
