
Молекулярная физика (2 семестр) Кл. / Лаб.№3 / Лабораторная работа №3
.docxБланк лабораторной работы
ПЕТРОЗАВОДСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕСИТЕТ
Кольский филиал
|
ФИО: Климов Андрей Александрович |
Наименование лабораторной работы: Лабораторная работа № 3 Определение удельной теплоты кристаллизации и изменения энтропии при охлаждении олова |
||||||
|
Факультет: Физико-энергетический |
|||||||
|
Курс, группа: 1курс, 1 группа |
Цель работы: определение изменения энтропии при фазовом переходе первого рода на примере кристаллизации олова из расплава при его охлаждении. Определение теплоты кристаллизации олова из закона сохранения энергии |
||||||
|
Этап работы |
Оценка |
Дата |
Преподаватель |
|
|||
|
Допуск |
|
|
|
|
|||
|
Окончание |
|
|
|
Принадлежности: |
|||
|
Итоговая оценка |
|
||||||
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ И МЕТОДИКА ИЗМЕРЕНИЙ
Плавлением - переход вещества из кристаллического состояния в жидкое.
Кристаллизация - образование кристалла из жидкой фазы.
Удельной теплотой кристаллизации (также: энтальпия кристаллизации; также существует равнозначное понятие уде́льная теплота́ плавления) количество теплоты, которое выделяет одна единица массы вещества в жидком состоянии в равновесном изобарно-изотермическом процессе при кристаллизации.
Энтропией называется функция состояния системы дифференциал которой dS = dQ/T, где dQ- бесконечно малое количество теплоты, сообщенное системе в элементарном обратимом процессе, Т - абсолютная температура системы.
Удельной теплоемкостью вещества называется скалярная физическая величина, равная отношению теплоемкости однородного тела c к его массе m.
Закон сохранения энергии: во всех процессах, происходящих в природе, энергия не возникает и не исчезает, она только превращается из одного вида в другой в эквивалентных количествах.
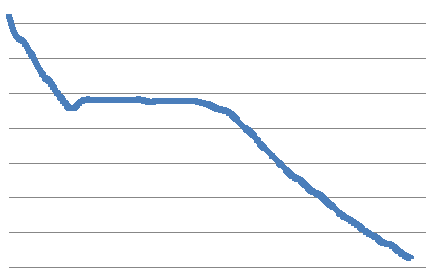
Линия, которая отделяет область только жидкой фазы от области, состоящей из жидкости и твердой фазы, называется ликвидусом или линией ликвидуса, а линия, отделяющая смесь жидкости и твердого от области, в которой присутствует только твердая фаза, известна под названием солидуса или линией солидуса.
Если расплавленное вещество осторожно охлаждать, то удается понизить его температуру ниже нормальной точки кристаллизации, причем оно продолжает оставаться жидким. Однако такое состояние крайне неустойчиво: часто бывает достаточно простого встряхивания, чтобы началась кристаллизация. При этом начинает выделяться теплота кристаллизации, обусловливающая повышение температуры до нормальной точки плавления (кристаллизации) данного вещества; эта температура сохраняется без изменений, пока жидкая фаза не перейдет в твердую.
В работе измеряются следующие величины: температура кристаллизации олова TK , время кристаллизации ΔτK, зависимость температуры олова от времени его охлаждения Т = f(τ). Простейшей моделью охлаждения тела является охлаждение в среде с постоянной температурой ТC когда внутри тела в течении всего процесса охлаждения температура в любой точке тела одинакова в любой момент времени.
Количество теплоты, которое нужно затратить для охлаждения системы тел (олово и ампула):
 (3.1)
(3.1)
а для количества теплоты, которое получит окружающая среда через поверхность ампулы F за время dτ:
 (3.2)
(3.2)
Применяя закон сохранения энергии можно получить уравнение:
 (3.3)
(3.3)
где сO - удельная теплоемкость олова; сА - удельная теплоемкость ампулы; mO - масса олова; mA - масса ампулы; TK - температура твердого олова; ТC - температура окружающей среды; α - коэффициент теплоотдачи с поверхности ампулы в окружающую среду (считается постоянной).
Рассмотрим процесс кристаллизации олова. Здесь выделяется количество теплоты равное:
 (3.4)
(3.4)
которое ведет к замедлению кристаллизации. Тепло, полученное окружающей средой через поверхность ампулы за время кристаллизации равно:
 (3.5)
(3.5)
Применяя закон сохранения к процессу кристаллизации олова, получим уравнение:
 (3.6)
(3.6)
Приравняем
(3.3) и (3.6), найдем:
 (3.8)
(3.8)
Изменение энтропии в любом обратимом процессе, переводящем систему из состояния 1 в состояние 2 (рис. 3.1), равно приведенному количеству теплоты, переданному системе в этом процессе:
 ;
;
 (3.9)
(3.9)
Следовательно, для определения теплоты кристаллизации λK и ΔS изменения энтропии в этом процессе необходимо измерить TK, ΔτK и вычислить производную dT/dτ функции Т=f(τ) в произвольной точке, соответствующей температуре твердого олова в процессе его охлаждения.
