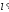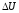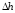- •Анализ политропного процесса
- •Основные обозначения
- •2. Задание на курсовую работу
- •3. Теоретический анализ обратимого политропного процесса
- •2.1. Определение политропного процесса
- •2.2. Вывод уравнения политропного процесса в переменных (p,V)
- •2.3. Способы определения показателя политропы
- •2.4. Вычисление параметров состояния в начале и в конце процесса
- •2.5. Вычисление теплоемкости и количества теплоты процесса
- •2.6. Вычисление работы изменения объема и внешней работы
- •2.7. Вычисление изменения термодинамических функций
- •4. Расчет политропного процесса
- •4.1. Расчет термодинамических свойств
- •4.2. Определение параметров в начале и в конце процесса
- •4.3. Расчет удельных характеристик процесса
- •5. Список использованных источников
2.7. Вычисление изменения термодинамических функций
Для вычисления изменения внутренней энергии и энтальпии необходимо проинтегрировать два последних уравнения в (3). Тогда
изменение внутренней энергии
 (18)
(18)
изменение энтальпии
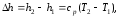 (19)
(19)
Выражение для изменения энтропии можно получить на основании II закона термодинамики для необратимых процессов:
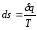 (20)
(20)
Тогда изменение энтропии
 (21)
(21)
Уравнение
политропного процесса в переменных
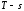 следует из определения количества
теплоты через теплоёмкость (3) и из
математической записи второго начала
термодинамики (20):
следует из определения количества
теплоты через теплоёмкость (3) и из
математической записи второго начала
термодинамики (20):

Если известны значения температуры и энтропии в начальном состоянии, то после нахождения произвольной постоянной получаем:
 (22)
(22)
Графическое
изображение политропного процесса в
переменных
 на основании (22) представлено на рис.3.
на основании (22) представлено на рис.3.

Рис.3.
Изображение политропного процесса в
диаграмме
 для различных значений показателя
политропы
для различных значений показателя
политропы .
.
Примечание.
Для адиабатического процесса
 Расчёт проводится по приведённым
формулам политропного процесса с заменойn
на k.
Из первого закона термодинамики при
Расчёт проводится по приведённым
формулам политропного процесса с заменойn
на k.
Из первого закона термодинамики при
 следует:
следует:
 (23)
(23)
где
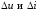 вычисляются по формулам (18) и (19).
вычисляются по формулам (18) и (19).
4. Расчет политропного процесса
4.1. Расчет термодинамических свойств
4.1.1. Расчет газовых постоянных и удельных массовых теплоемкостей компонентов смеси
Молекулярные массы компонентов смеси:
µ1 = 28 кг/кмоль, µ2 = 32 кг/кмоль
Удельные
массовые теплоёмкости (по классической
теории теплоёмкостей
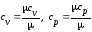 )
и газовые постоянные компонентов смеси
(по формуле
)
и газовые постоянные компонентов смеси
(по формуле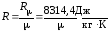 )
)



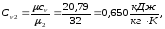


4.1.2. Вычисление массовых долей компонентов смеси
Полная масса смеси:

Массовые доли компонентов смеси:


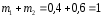
4.1.3. Удельные теплоёмкости смеси


4.1.4. Газовая постоянная смеси
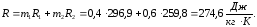
4.1.5 Показатель адиабаты смеси
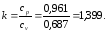
4.2. Определение параметров в начале и в конце процесса
Из
уравнения состояния
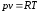 имеем:
имеем:

Из соотношений между параметрами в политропном процессе (12) находим конечные удельный объём и температуру смеси:


Рассчитанные параметры представлены в таблице 2.
Таблица 2
Термодинамические параметры в начальном и конечном состояниях
|
Параметры |
Размерность |
Состояние 1 |
Состояние 2 |
|
p |
бар |
5 |
1 |
|
v |
м3/ кг |
0,349 |
0,814 |
|
t |
ºC |
350 |
17,7 |
|
T |
K |
623 |
290,7 |
4.3. Расчет удельных характеристик процесса
4.3.1. Удельная работа изменения объема

4.3.2. Удельная внешняя работа

Проверка величины показателя политропы по (9):

4.3.3. Удельное количество теплоты процесса
Предварительно вычисляем теплоёмкость процесса в соответствии с (13)
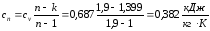
Тогда количество теплоты, участвующее в процессе:

4.3.4. Расчёт изменения термодинамических функций по (18), (19), (21)

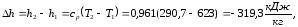

Данные расчётов сведены в таблицу 3.
Таблица 3
Результаты расчета политропного процесса
|
|
кДж/ кг |
101,4 |
|
кДж |
253,5 |
|
|
кДж/ кг |
192,7 |
|
кДж |
481,75 |
|
|
кДж/ кг |
-126,9 |
|
кДж |
-317,25 |
|
|
кДж/ кг |
-228,3 |
|
кДж |
-570,75 |
|
|
кДж/ кг |
-319,3 |
|
кДж |
-799 |
|
|
кДж/кг·К |
-0,2915 |
|
кДж/·К |
-0,729 |
4.3.5.Проверка расчетов по первому закону термодинамики


Абсолютная погрешность расчета


4.3.6.Изображение
процесса на диаграммах
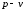 и
и