
Реакция связывания комплимента (рск) с парными сыворотками
Реакция протекает в две фазы. Первая фаза - взаимодействие антигена и антител при обязательном участии комплемента. Вторая - выявление результатов реакции при помощи индикаторной гемолитической системы (эритроциты барана и гемолитическая сыворотка). Разрушение эритроцитов гемолитической сывороткой происходит только в случае присоединения комплемента к гемолитической системе. Если же комплемент адсорбировался ранее на комплексе антиген-антитело, то гемолиз эритроцитов не наступает. Результат опыта оценивают, отмечая наличие или отсутствие гемолиза во всех пробирках. Реакцию считают положительной при полной задержке гемолиза, когда жидкость в пробирке бесцветна и эритроциты оседают на дно, отрицательной - при полном лизисе эритроцитов, когда жидкость интенсивно окрашена («лаковая» кровь). Степень задержки гемолиза оценивают в зависимости от интенсивности окраски жидкости и величины осадка эритроцитов на дне (++++, +++, ++, +).
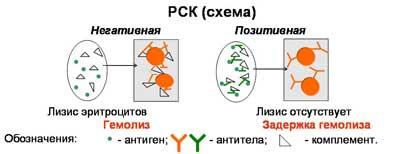
Постановка и опыт
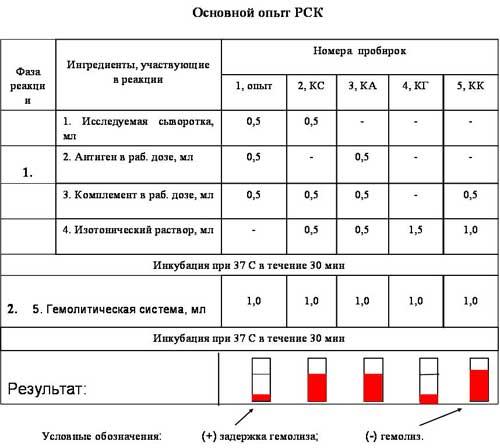
Выводы: В исследуемой сыворотке выявлены антитела.
РСК позволяет выявить антитела к любому штамму одного и того же серотипа вируса. Диагностическое значение имеет четырехкратное увеличение титра антител в парных сыворотках (в период эпидемии гриппа) и двукратное нарастание в сыворотках крови больных при характерной клинической картине.
РСК с парными сыв-ками.
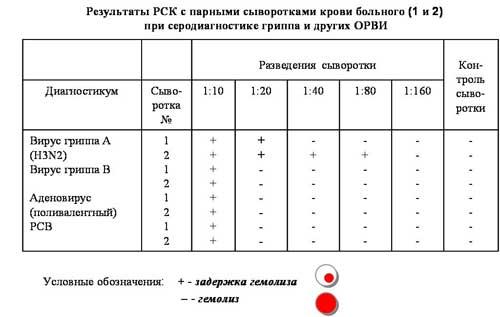
Выводы: В парных сыворотках больного выявлено четырехкратное увеличение титра антител к вирусу гриппа А.
Реакция нейтрализации (рн) – вирусы и ат.
Эту реакцию используют при вирусных заболеваниях как для определения антител в крови больного, так и для идентификации вирусов, выделенных у больных . Принцип реакции нейтрализации заключается в том, что специфические иммунные сыворотки способны гасить инфекционное действие вируса при смешивании вирус содержащего материала и соответствующих вирусу иммунных сывороток. Эффект нейтрализации вируса антителами определяют, вводя смесь чувствительному животному, после выдерживания ее в течение определенного времени. Постановку реакции нейтрализации осуществляют в двух модификациях:
1) титруют (разводят) взвесь или исследуемый материал и соединяют эти разведения с определенной постоянной дозой иммунной сыворотки;
2) постоянную определенную дозу вируса соединяют с различными дозами иммунной сыворотки — титруют сыворотку.
О результатах реакции нейтрализации судят по гибели чувствительных животных, зараженных смесью вирус содержащего материала и сыворотки, или по клинической картине заболевания. В культуре клеток определяют цитопатический эффект — гибель клеток. В случае выделения вируса у больного и при необходимости идентификации его применяют известную иммунную вирус нейтрализующую сыворотку.
Реакцию нейтрализации можно также использовать при установлении типа ботулинического токсина, применяя токсиннейтрализующие специфические иммунные сыворотки, и для определения токсина возбудителя газовой гангрены.
РГА и РТГА – титр и тип вируса.
В основе реакции гемагглютинации лежит феномен склеивания эритроцитов, происходящий под влиянием различных факторов. Различают прямую и непрямую гемагглютинацию. При реакции прямой гемагглютинации происходит склеивание эритроцитов при адсорбции на них определенных антигенов, например вирусов.
В серологических исследованиях применяют реакцию торможения прямой гемагглютинации, когда выделенный у больного вирус нейтрализуют специфической иммунной сывороткой, а затем соединяют с эритроцитами. Отсутствие гемагглютинации говорит о соответствии вируса и используемой иммунной сыворотки.
РНГА с эритроцитами Vi и для титра антител.
Реакция непрямой гемагглютинации (пассивная гемагглютинация) наблюдается в тех случаях, когда к эритроцитам, заранее обработанным (сенсибилизированным) различными антигенами, прибавляют иммунную сыворотку или сыворотку больного, имеющую соответствующие антитела. Происходит специфическое склеивание эритроцитов, их пассивная гемагглютинация.
Реакция непрямой, или пассивной, гемагглютинации по чувствительности и специфичности превосходит другие серологические методы, и ее используют при диагностике инфекций, вызванных бактериями, риккетсиями, простейшими.
Методика постановки реакции непрямой гемагглютинации состоит из нескольких этапов. Вначале эритроциты отмывают изотоническим раствором хлорида натрия, затем при необходимости (при использовании антигенов белковой природы) их обрабатывают раствором танина 1 : 20000 и сенсибилизируют растворимыми антигенами. После отмывания буферным изотоническим раствором хлорида натрия эритроцитарный антиген готов к употреблению. Исследуемые сыворотки разводят изотоническим раствором хлорида натрия в пробирках или специальных пластмассовых пластинках с луночками, затем к каждому разведению сыворотки добавляют эритроцитарный диагностикум. Результаты реакции непрямой гемагглютинации учитывают по характеру осадка эритроцитов, образовавшегося на дне пробирки. Положительным считают результат реакции, при котором эритроциты равномерно покрывают все дно пробирки. При отрицательной реакции эритроциты в виде маленького диска или «пуговки» располагаются в центре дна пробирки.
Серологическую диагностику (РНГА в парных сыворотках с эритроцитарным брюшнотифозным О-диагностикумом) проводят с конца первой недели заболевания, однако минимальный диагностический титр AT (1:200) впервые можно выявить и в более поздние сроки заболевания (на 3-й неделе болезни). РНГА с эритроцитарным брюшнотифозным Vi-диагностикумом у больных брюшным тифом имеет вспомогательное значение (минимальный диагностический титр 1:40). Чаще эту реакцию используют для отбора лиц, подозрительных на бактерионосительство. При титрах AT 1:80 и выше этим лицам проводят многократное бактериологическое исследование.
Из серологических методов используют реакцию непрямой гемагглю-тинации и ИФА. Определяют титр АТ к дифтерийному токсину в начале заболевания (1-3-й день) и через 7-10 сут, диагностическим считают нарастание титра АТ не менее чем в 4 раза. РПГА отличается высокой чувствительностью и специфичностью. В последние годы на смену РПГА приходит метод ИФА, обладающий ещё большими чувствительностью и специфичностью.
При выявлении контингента для проведения вакцинации определяют титр АТ до вакцинации, если он низкий или АТ отсутствуют, пациентам показано вакцинация, о её эффективности судят по нарастанию титра АТ после вакцинации. Главная цель активной иммунизации — выработка специфического иммунитета. Анатоксин служит непреодолимым барьером для дифтерийного токсина и защищает организм от интоксикации. При подборе контингента для вакцинации необходимо руководствоваться критериями, приведёнными в табл. [Goldman L., Bennett J.C., 2000].
Определение титра АТ к дифтерийному токсину необходимо для диагностики дифтерийной инфекции, оценки напряжённости иммунитета у обследуемых, оценки эффективности вакцинации дифтерийной вакциной.
Таблица Титры антитоксических АТ, характеризующих степень восприимчивости к дифтерии
