
- •Основы термодинамики
- •Глава 1. Основные понятия.
- •Глава 2. Температура. I закон термодинамики.
- •Neкипение 1 27,102 -246,048
- •Если в наличии конечное изменение состояния, то имеем конечный процесс 1→2
- •Для газов величину γ можно определить, измеряя скорость звука в газе :
- •Глава 3. Термохимия.
- •Для облегчения расчетов следует поступать так
- •Глава 4. Второй закон.
- •Легко сообразить, чтобы дать ответ на поставленный вопрос, необходимо взять
- •Глава 5. Процессы в неизолированных системах.
- •Глава 6. Равновесие в однокомпонентных гетерогенных системах. Уравнение Клапейрона – Клаузиуса
- •Глава 7. Термодинамические свойства многокомпонентных систем. Растворы. Химический потенциал.
- •Полный дифференциал внутренней энергии открытой системы можем записать
- •Глава 8. Термодинамика смесей идеальных газов.
- •Глава 9. Смеси жидкостей.
- •Глава 10. Реальные растворы.
- •Как было отмечено ранее, выражение
- •Заметим, что производная от экстенсивной функции по числу молей I–ого компонента является парциальной мольной величиной только в случае постоянства вышеуказанных независимых переменных:
- •Глава 11. Коллигативные свойства растворов.
- •После логарифмирования и дифференцирования имеем
- •Глава 12. Растворы электролитов – термодинамика.
- •Глава 13. Гетерогенное равновесие многокомпонентных систем без химических реакций.
- •Глава 14. Термодинамические свойства реального газа. Летучесть.
- •Если газ реальный и работа его изотермического изменения объема
- •Как мы узнаем ниже, разность е(р) – е(1) умноженная на 2f ( f – число Фарадея, равное 96487 кулонов/г-экв ) как раз равна работе расширения водорода при 25 0с от давления р до 1 атм
- •Глава 15. Термодинамика системы с химической реакцией.
- •Задача легко решается для идеально-газовой смеси, поскольку для нее
- •Глава 16. Тепловая теорема Нернста
- •Проблема возникает при интегрировании уравнения
- •Так как
- •По соотношению Максвелла
- •Глава 17. Элементы термодинамики неравновесных систем.
- •Глава 18. Неравновесные явления в растворах электролитов.
- •Это уравнение Нернста – Эйнштейна связывает коэффициент диффузии иона с его электрической подвижностью.
- •Глава 19. Равновесные электрохимические системы
- •Глава 20. Неравновесные электрохимические системы, основы электрохимической кинетики.
Задача легко решается для идеально-газовой смеси, поскольку для нее

и
так как ![]() то
то

и, следовательно, состав равновесной системы зависит от знака Σ νi , т.е. от знака изменения числа молей газообразных участников реакции. Однако, как мы увидим ниже, случай, когда Σ νi = 0, требует дополнительного изучения.
15.8. Расчет константы равновесия по таблицам термодинамических величин.
Из вышеизложенного очевидно, что для определения направления химического процесса в системе данного состава необходимо знать величину константы равновесия при данной температуре.
Тепловой
эффект химической реакции
![]() и ее энтропия (
и ее энтропия (![]() )
при 298,15 К легко рассчитываются с помощью
энтальпий образования (
)
при 298,15 К легко рассчитываются с помощью
энтальпий образования (![]() )
и абсолютных энтропий (
)
и абсолютных энтропий (![]() )
участников химической реакции по закону
Гесса :
)
участников химической реакции по закону
Гесса :
![]()
При температурах, отличающихся от условной (298 К)

таким образом необходимо знать зависимость теплоемкостей участников химического процесса от температуры и тогда при температуре T > 298 K

и ![]()
Практически стоит иметь в виду, что два интеграла в правой части приблизительно равны по величине и противоположны по знаку, поэтому для оценочных расчетов можно записать
![]()
Точный расчет можно выполнить следующим образом (метод Темкина – Шварцмана, 1948). При температурах выше 298 К зависимость теплоемкости вещества от температуры аппроксимируется полиномом :
![]()
следовательно
![]() тоже полином:
тоже полином:

Далее по уравнению Гиббса-Гельмгольца
![]()
Разделим переменные и возьмем интегралы от 298 до Т
![]()

Так как Δ а, Δ b, Δ d и Δ m от температуры не зависят, то интегралы берутся без труда и

Выражения, стоящие при Δ а, Δ b, Δ d и Δ m являются функциями только температуры, обозначаются М0 , М1 , М2 и М-2 могут быть заранее вычислены и табулированы, что сделали Темкин и Шварцман. Значения этих коэффициентов приводятся в справочниках физико-химических величин. Таким образом :
![]()
Пример. Рассчитать константу равновесия и степень диссоциации водяного пара при 2000 К.
![]()
|
|
-241840 |
0 |
0 |
Дж/моль |
|
|
188,74 |
130,6 |
|
|
|
а |
30,00 |
27,28 |
|
|
|
в |
|
|
|
|
|
т |
|
|
|
|

При
2000 К ![]()
Тогда

Степень
диссоциации рассчитаем следующим
образом. Если был взят 1 моль водяного
пара, то после диссоциации α молей Н2О
образовалось при равновесии α молей Н2
и
![]() молейО2
. Общее число молей газовой смеси станет
молейО2
. Общее число молей газовой смеси станет
![]() тогда
мольные доли реагентов равны :
тогда
мольные доли реагентов равны :
![]()
![]()
Если общее давление Р , то парциальные давления :
![]()
и следовательно

Таким
образом, имея величину Кр
и задав давление Р,
можно вычислить α. Выражение можно
упростить, если ![]() тогда
тогда

и 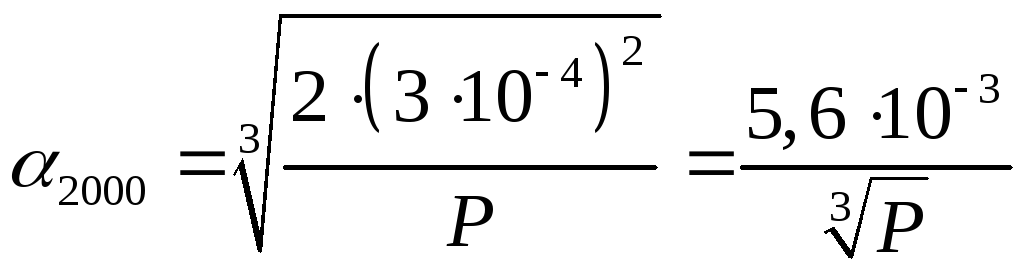
Если
Р = 1 атм ,
то ![]()
15.9. Расчет константы равновесия в неидеальных газовых системах.
В газообразной системе, где давление достаточно велико, условие равновесия приводит к выводу, что
![]()
где
fi
- летучесть
i
–ого компонента. Поскольку ![]() где
γi
- коэфициент
летучести, то очевидно, что
где
γi
- коэфициент
летучести, то очевидно, что
![]()
Поскольку при р = 1 атм, коэфициенты летучести равны единице, то численное значение Kf очевидно равно величине Kp при р = 1.
Для расчета величин γ удобно воспользоваться законом соответственных состояний.
Пример.
Реакция ![]() и давление как будто не должно влиять
на состав равновесной системы. Рассмотрим
эту систему при 900К и500 атм
и давление как будто не должно влиять
на состав равновесной системы. Рассмотрим
эту систему при 900К и500 атм
|
|
Ркр |
Ткр |
τ |
π |
γ |
|
СО |
34,6 |
134 |
6,72 |
14,45 |
1,2 |
|
Н2О |
218,5 |
647 |
1,39 |
2,29 |
0,7 |
|
Н2 |
12,8 |
33 |
21,9 |
24,05 |
1,1 |
|
СО2 |
73 |
304 |
2,96 |
6,84 |
1,1 |
Отсюда

Следовательно, состав равновесной смеси сдвигается в сторону исходных веществ при увеличении давления.
Пример. Равновесие синтеза аммиака.
-

1 моль исходной стехиометрической смеси, а при равновесии получаем х молей аммиака.

Температура 723 К
|
|
|
|
|
|
|
|
|
Ратм |
хэксп |
|
|
|
|
|
|
1 |
0,0021 |
6,50 |
1 |
1 |
1 |
6,50 |
|
10 |
0,0204 |
6,59 |
1,003 |
1,005 |
0,997 |
6,53 |
|
30 |
0,0380 |
6,76 |
1,01 |
1,014 |
0,991 |
6,55 |
|
50 |
0,0917 |
6,90 |
1,015 |
1,024 |
0,985 |
6,57 |
|
100 |
0,1636 |
7,25 |
1,03 |
1,047 |
0,970 |
6,57 |
|
300 |
0,355 |
8,84 |
1,09 |
1,14 |
0,910 |
6,62 |
|
600 |
0,536 |
12,94 |
1,18 |
1,33 |
0,83 |
7,27 |
|
1000 |
0,694 |
23,28 |
1,36 |
1,61 |
0,89 |
10,39 |
Примечание
: коэфициенты летучести найдены исходя
из закона соответственных состояний,
как ![]() .
.
Например, при 300 атм Кγ = 0,795
![]()
Подставив
величины
![]() иР
, получаем расчетное
иР
, получаем расчетное ![]() что
очень близко к экспериментальной
величине 0,355.Из таблицы видно также, что
при давлениях выше 300атм
постоянства
Kf
не наблюдается,
но это, очевидно, связано со способом
оценки величин γ по закону соответственных
состояний.
что
очень близко к экспериментальной
величине 0,355.Из таблицы видно также, что
при давлениях выше 300атм
постоянства
Kf
не наблюдается,
но это, очевидно, связано со способом
оценки величин γ по закону соответственных
состояний.
