
- •Основы термодинамики
- •Глава 1. Основные понятия.
- •Глава 2. Температура. I закон термодинамики.
- •Neкипение 1 27,102 -246,048
- •Если в наличии конечное изменение состояния, то имеем конечный процесс 1→2
- •Для газов величину γ можно определить, измеряя скорость звука в газе :
- •Глава 3. Термохимия.
- •Для облегчения расчетов следует поступать так
- •Глава 4. Второй закон.
- •Легко сообразить, чтобы дать ответ на поставленный вопрос, необходимо взять
- •Глава 5. Процессы в неизолированных системах.
- •Глава 6. Равновесие в однокомпонентных гетерогенных системах. Уравнение Клапейрона – Клаузиуса
- •Глава 7. Термодинамические свойства многокомпонентных систем. Растворы. Химический потенциал.
- •Полный дифференциал внутренней энергии открытой системы можем записать
- •Глава 8. Термодинамика смесей идеальных газов.
- •Глава 9. Смеси жидкостей.
- •Глава 10. Реальные растворы.
- •Как было отмечено ранее, выражение
- •Заметим, что производная от экстенсивной функции по числу молей I–ого компонента является парциальной мольной величиной только в случае постоянства вышеуказанных независимых переменных:
- •Глава 11. Коллигативные свойства растворов.
- •После логарифмирования и дифференцирования имеем
- •Глава 12. Растворы электролитов – термодинамика.
- •Глава 13. Гетерогенное равновесие многокомпонентных систем без химических реакций.
- •Глава 14. Термодинамические свойства реального газа. Летучесть.
- •Если газ реальный и работа его изотермического изменения объема
- •Как мы узнаем ниже, разность е(р) – е(1) умноженная на 2f ( f – число Фарадея, равное 96487 кулонов/г-экв ) как раз равна работе расширения водорода при 25 0с от давления р до 1 атм
- •Глава 15. Термодинамика системы с химической реакцией.
- •Задача легко решается для идеально-газовой смеси, поскольку для нее
- •Глава 16. Тепловая теорема Нернста
- •Проблема возникает при интегрировании уравнения
- •Так как
- •По соотношению Максвелла
- •Глава 17. Элементы термодинамики неравновесных систем.
- •Глава 18. Неравновесные явления в растворах электролитов.
- •Это уравнение Нернста – Эйнштейна связывает коэффициент диффузии иона с его электрической подвижностью.
- •Глава 19. Равновесные электрохимические системы
- •Глава 20. Неравновесные электрохимические системы, основы электрохимической кинетики.
Заметим, что производная от экстенсивной функции по числу молей I–ого компонента является парциальной мольной величиной только в случае постоянства вышеуказанных независимых переменных:
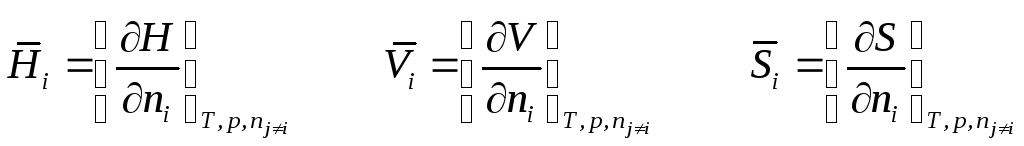
Химический потенциал компонента μi может быть представлен производной от различных термодинамических функций
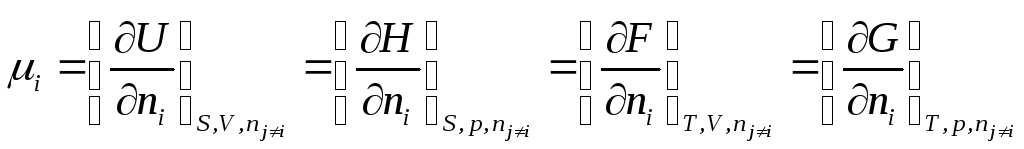
но только последняя производная является парциальной мольной величиной,
![]() .
.
Экстенсивные свойства – однородные функции первого порядка относительно чисел молей компонентов, и по теореме Эйлера для однородных функций

Поскольку полный дифференциал Z
 и
и
![]()
то легко получить обобщенное уравнение Гиббса-Дюгема :
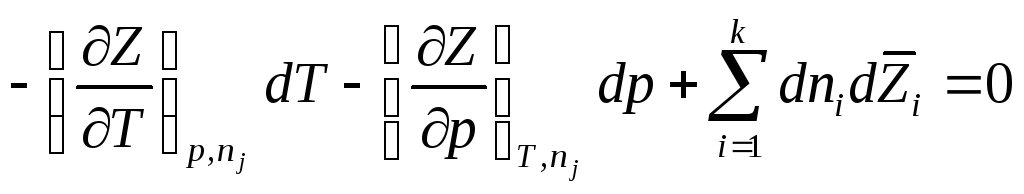
Если
![]() , в
частности если
, в
частности если![]() , то
, то
![]() и
при
и
при
![]()
Между парциальными мольными величинами существуют те же соотношения, что и между интегральными, например,

Будем
рассматривать в дальнейшем бинарную
систему (наиболее частый случай) и пусть
общее количество вещества в системе 1
моль, т.е. ![]() тогда
тогда
![]() и
и ![]() , а
поскольку
, а
поскольку
![]()
Для бинарной системы Z = Z (T, p, xi ) и
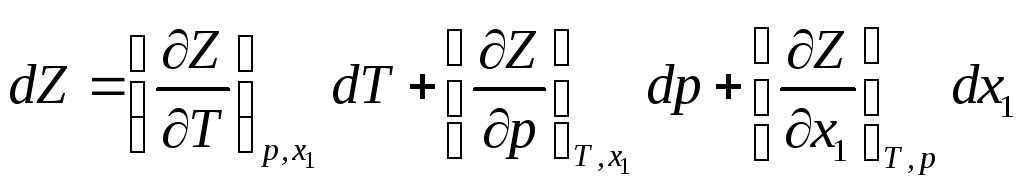
С другой стороны
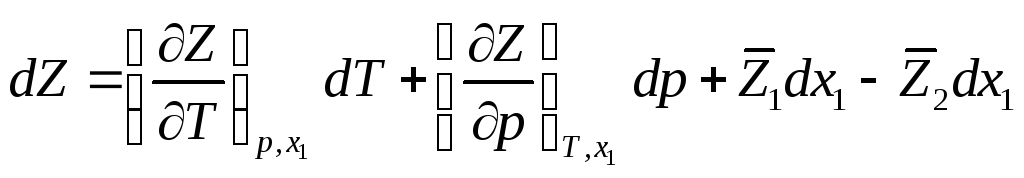
Сравнив оба выражения, имеем
![]()
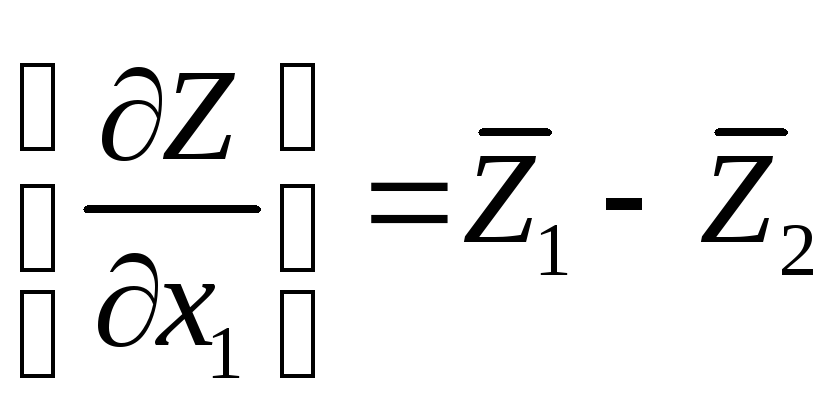 Кроме
того
Кроме
того
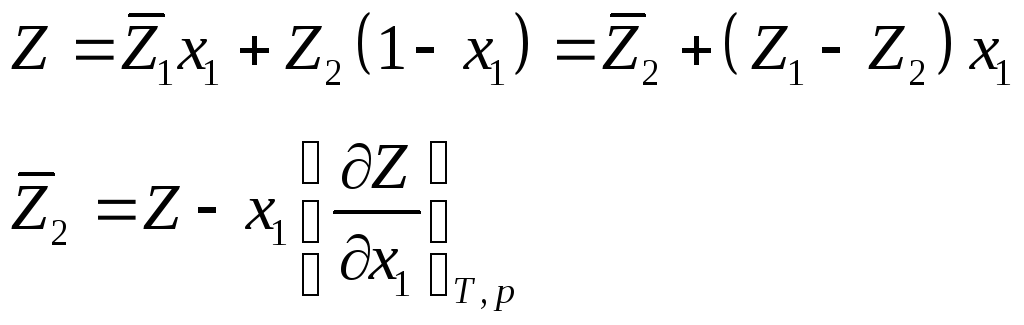
Функцией
смешения
![]() называется изменениеZ
при образовании раствора из чистых
компонентов. Для 1 моля раствора
называется изменениеZ
при образовании раствора из чистых
компонентов. Для 1 моля раствора
![]()
Заметим,
что для чистого компонента ![]()
Парциальная мольная функция смешения
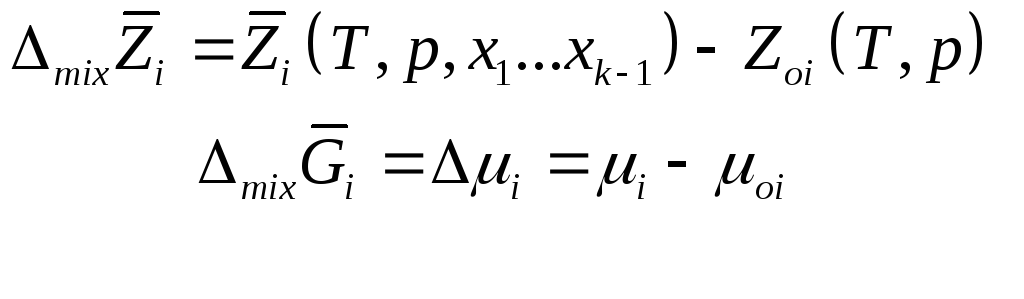
Очевидно,
что ![]()
Для бинарной системы
![]()
Очевидно,
что касательная в точке х1
к зависимости
интегральной ![]() отх1
отсекает на
ординатах х1
= 0 и х1
= 1 отрезки,
равные соответственно
отх1
отсекает на
ординатах х1
= 0 и х1
= 1 отрезки,
равные соответственно
![]() и
и ![]()
Выведем
еще одну важную формулу. Обозначим через
А
некоторую функцию смешения ![]() ,
тогда уравнение Гиббса-Дюгема дает:
,
тогда уравнение Гиббса-Дюгема дает:
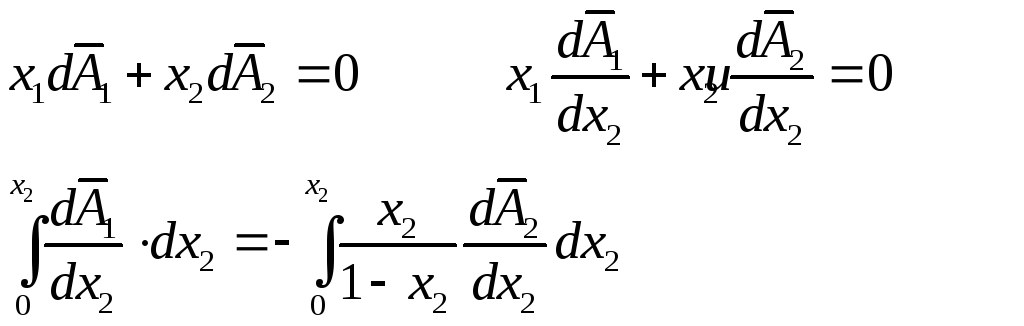
Левый
интеграл дает
![]() в точкех2,
правый после взятия по частям:
в точкех2,
правый после взятия по частям:
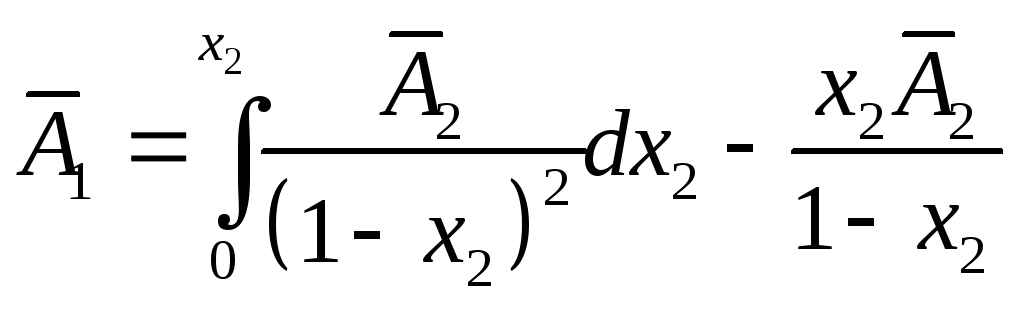 или
или

и 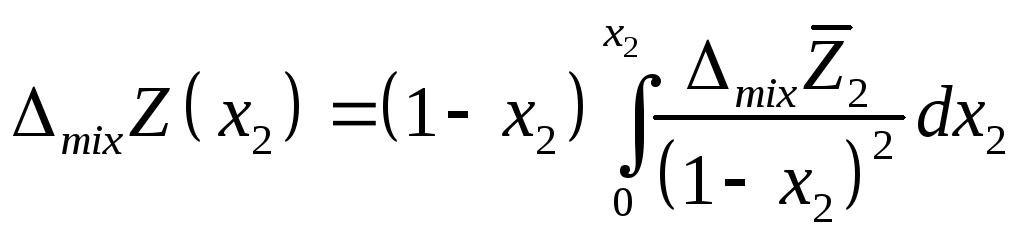
т.е. измерив парциальную мольную функцию смешения можно сразу вычислить и интегральную величину.
Заметим, что при вычислении химического потенциала компонента по измеренной активности другого удобнее интегрировать коэффициент активности поскольку его логарифм при xi → 0 не стремится в бесконечность
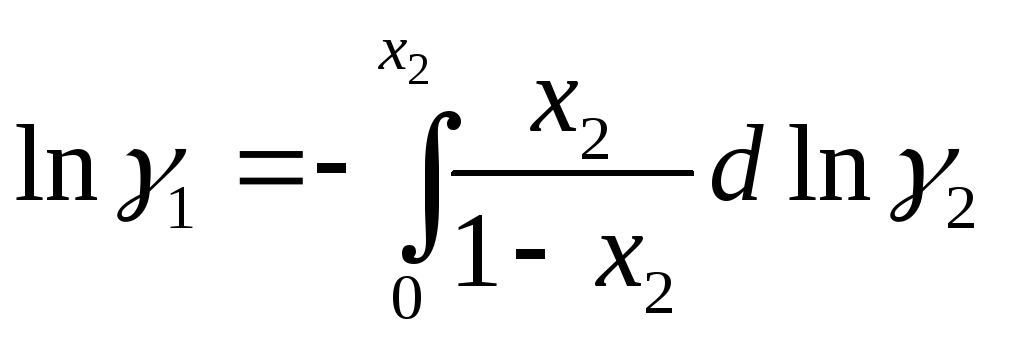
Избыточной функцией смешения называется разность между функцией смешения рассматриваемого раствора и идеального раствора той же концентрации.
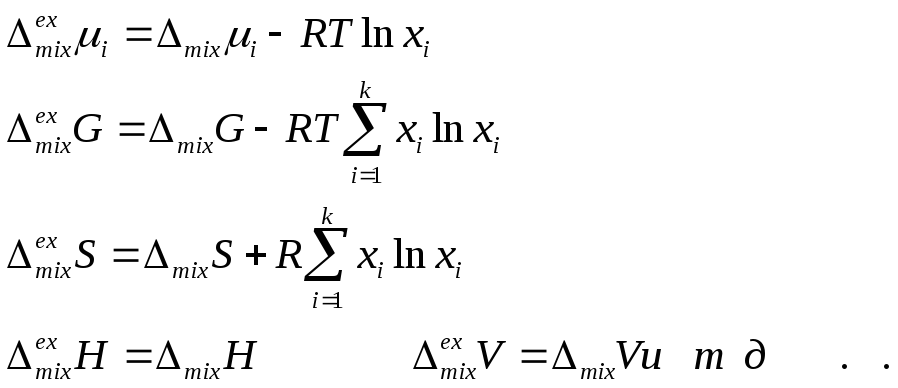
Глава 11. Коллигативные свойства растворов.
11.1. Растворимость твердого вещества в идеальном растворе.
Растворимость твердого вещества в данном растворе измеряется концентрацией его насыщенного раствора при данной температуре и давлении. Насыщенный раствор – это раствор, находящийся в равновесии с кристаллами твердого вещества, следовательно в насыщенном растворе химические потенциалы растворенного вещества в жидкой и твердой фазах одинаковы:
μ2 (раствор) = μ2 (кристаллы)
Если при растворении твердого вещества образуется идеальный раствор, то химический потенциал этого вещества в насыщенном растворе будет:
μ2 (раствор) = μ02 (ж) +RT ln x2нас ,
где μ02 (ж) – химический потенциал чистого растворенного вещества в жидком состоянии. Тогда, очевидно,
![]()
Но ![]() изменение
энергии Гиббса при плавлении 1 моля
растворенного вещества при температуре
раствора. По уравнению Гиббса-Гельмгольца
изменение
энергии Гиббса при плавлении 1 моля
растворенного вещества при температуре
раствора. По уравнению Гиббса-Гельмгольца
![]()
где Δ G и Δ Н относятся к одному и тому же процессу, поэтому получаем при постоянном давлении
![]()
В
полученном уравнении отсутствуют
величины, характеризующие индивидуальные
свойства растворителя. Следовательно,
идеальная растворимость твердых тел
не зависит от природы растворителя. А
поскольку ![]() ,
то
,
то ![]() ,
т.е. с ростом температуры идеальная
растворимость увеличивается.
,
т.е. с ростом температуры идеальная
растворимость увеличивается.
Разделим
переменные и возьмем интеграл от ![]() - температуры плавления чистого твердого
вещества до
- температуры плавления чистого твердого
вещества до ![]() -состава насыщенного раствора при
температуре Т
-состава насыщенного раствора при
температуре Т
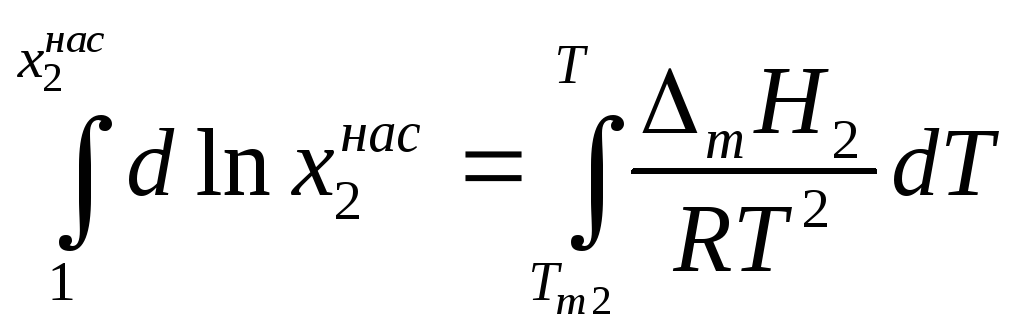
Теплоемкости жидкого и твердого вещества сравнительно мало отличаются друг от друга, поэтому можно предположить, что в интервале от Т до Тт2 ΔтН2 =const и после взятия интегралов имеем:
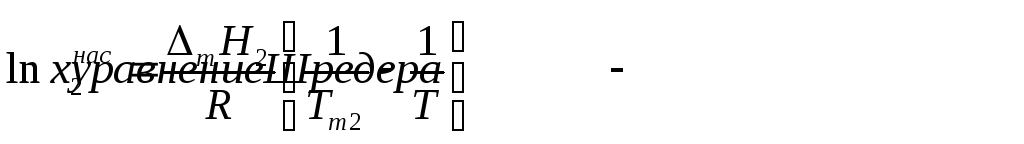
Поскольку Тт2 > T, то 1/Tm2 < 1 / T, следовательно, чем выше температура плавления вещества, тем меньше его растворимость. Заметим, что уравнение Шредера может оказаться весьма полезным для оценки растворимости твердых органических веществ, особенно при разработке процессов перекристаллизации, или для расчета необходимого количества растворителя.
Влияние давления на идеальную растворимость можно оценить следующим образом. Так как
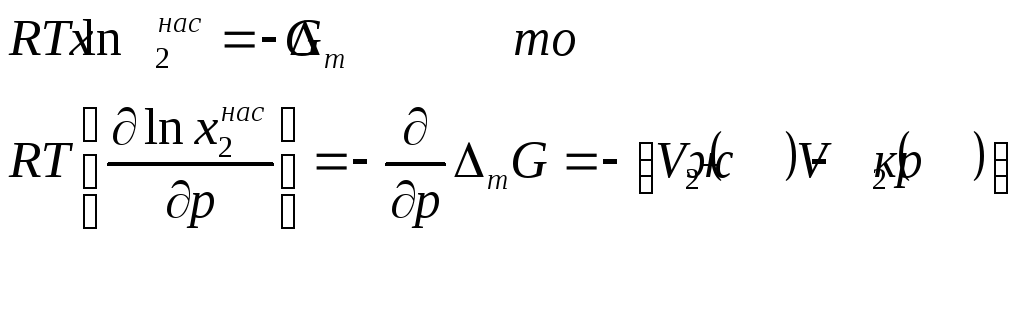
где V2(ж ) – мольный объем растворенного вещества в расплавленном переохлажденном состоянии при температуре раствора, V2(кр) – мольный объем твердого растворенного вещества. Для большинства веществ V2(ж ) > , V2(кр), поэтому с увеличением давления при постоянной температуре идеальная растворимость уменьшается.
11.2. Понижение температуры замерзания растворов. Криоскопия.
Будем понимать под температурой кристаллизации раствора ту температуру, при которой кристаллы растворителя находятся в равновесии с раствором, т.е. раствор при этой температуре становится насыщенным относительно растворителя. Из условий равновесия имеем :
μ1 (кр ) = μ1 ( р-р )
Если раствор достаточно разбавлен, то давление пара растворителя подчиняется закону Рауля р1 =р01 ·х1, поэтому
![]()
и, повторив выкладки предыдущего параграфа, получим
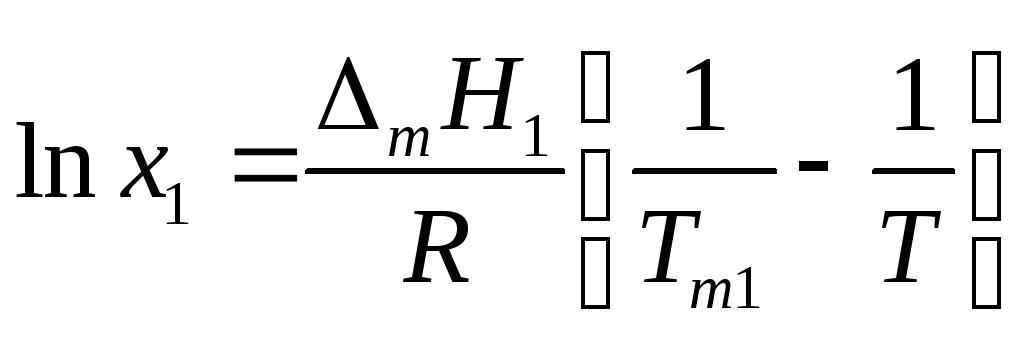
где Тт1 –температура кристаллизации чистого растворителя, Т – температура кристаллизации раствора, имеющего концентрацию растворителя х1 . Так как
![]() т.е.
температура замерзания чистого
растворителя выше, чем температура
замерзания раствора, причем последняя
определяется только его концентрацией
х1
и свойствами
растворителя ΔтН1
и Тт1.
т.е.
температура замерзания чистого
растворителя выше, чем температура
замерзания раствора, причем последняя
определяется только его концентрацией
х1
и свойствами
растворителя ΔтН1
и Тт1.
Преобразуем полученное уравнение:
![]()
Если
х2
мало (раствор разбавлен), то ![]()
и ![]()
Поскольку
в разбавленном растворе моляльность
т2
и мольная доля х2
связаны соотношением ![]()
где М1 - мольная масса растворителя, то
![]()
Величина К называется криоскопической константой растворителя.
С помощью измерений ΔТ для данного растворителя с известной К можно определить мольную массу растворенного вещества :
![]()
где g1 и g2 навески растворителя и растворенного вещества в граммах.
Криоскопия – один из способов определения мольных масс или чистоты вещества. Надежные результаты получаются в растворителях с высокими значениями криоскопических постоянных при условии, что при растворении не происходит диссоциации или ассоциации молекул растворенного вещества. Диссоциация Растворенного вещества приводит к увеличению его числа частиц ( ионов ). Поэтому для растворов электролитов :
![]()
где i – изотонический коэфициент Вант-Гоффе, показывающий во сколько раз увеличилось число частиц в растворе вследствие диссоциации :
i = 1 + α (n-1 )
где α –степень диссоциации, п –число ионов, на которые распадается молекула.
|
Растворитель |
К |
|
Вода |
1,86 |
|
Бензол |
5,12 |
|
Циклогексан |
20,0 |
|
Сероуглерод |
3,8 |
|
Камфора |
40 |
Если α = 1, то i = n. Однако i практически всегда меньше n, так как ионы в растворах не свободны, а связаны силами электростатического взаимодействия. Измерив ΔТ раствора известной моляльности можно определить изотонический коэффициент, а следовательно, степень диссоциации, что особенно пригодно для слабых электролитов. Приведем еще таблицу замерзания водноэтанольных растворов
|
m |
2 |
4 |
6 |
10 |
15 |
20 |
30 |
|
t 0C |
-3,6 |
-7,92 |
-12,3 |
-22 |
-30 |
-36 |
-42 |
11.3. Температура кипения растворов нелетучих веществ. Эбулиоскопия.
Раствор, как и любая жидкость, кипит, когда давление насыщенного пара станет равным внешнему давлению. Если растворенное вещество нелетуче, то пар будет содержать только растворитель и по закону Рауля давление пара растворителя над раствором всегда меньше, чем над чистым растворителем при той же температуре, поэтому раствор должен кипеть при более высокой температуре.
Если раствор достаточно разбавлен и соблюдается закон Рауля, то в точке кипения раствора
P (внешнее) = р1 =р01·х1
