
Лабораторная работа №1.
Тема: «Термодинамика – изотермический процесс»
Цель: наблюдать процесс изотермического сжатия или расширения
идеального газа.
Оборудование: универсальная компьютерная программа.
Задачи:
1) Следить за параметрами газа в данном процессе по графикам в координатах (P,V), (T,U), (T,P).
2) В любой момент времени сделать отсчет параметров P и V.
3) Используя калькулятор, выполнить необходимые расчеты и проверить полученный результат с помощью компьютера.
Результаты:
Опыт №1.
T = 248К
-
СИ
PV
P1 =
 Па
ПаV1= 40 дм3


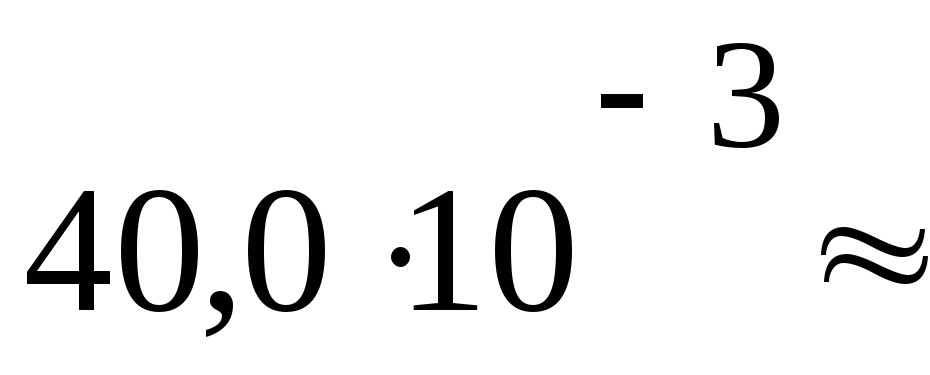 2040
Па м3
2040
Па м3P2 =
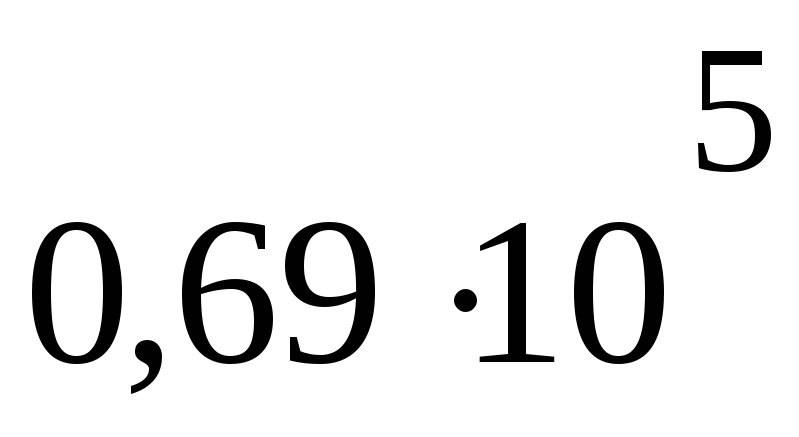 Па
ПаV2= 29,6 дм3


 2042
Па м3
2042
Па м3P3 =
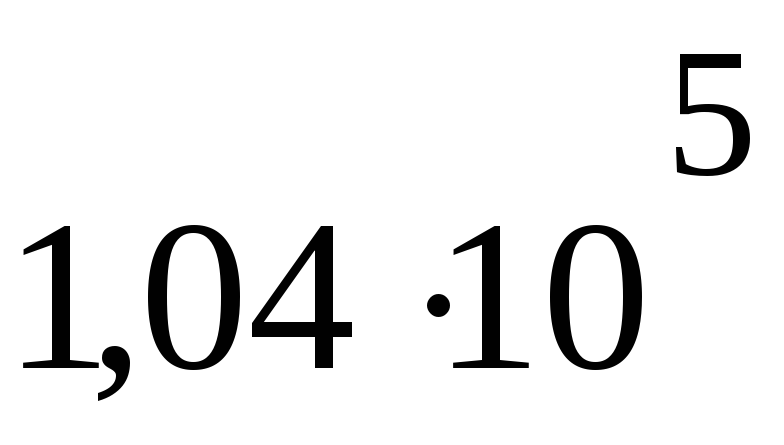 Па
ПаV3= 19,8 дм3


 2059
Па м3
2059
Па м3P4 =
 Па
ПаV4= 10 дм3


 2050
Па м3
2050
Па м3
PV
![]() 2400
Па м3
2400
Па м3
![]() 2420
Па м3
2420
Па м3
![]() 2059
Па м3
2059
Па м3
![]() 2052
Па м3
2052
Па м3
Опыт №2.
T = 353К
-
СИ
PV
P1 =
 Па
ПаV1= 40 дм3


 2960
Па м3
2960
Па м3P2 =
 Па
ПаV2= 29,9 дм3


 2930
Па м3
2930
Па м3P3 =
 Па
ПаV3= 20,1 дм3


 2954
Па м3
2954
Па м3P4 =
 Па
ПаV4= 10 дм3


 2920
Па м3
2920
Па м3
PV
![]() 2960
Па м3
2960
Па м3
![]() 2930
Па м3
2930
Па м3
![]() 2954
Па м3
2954
Па м3
![]() 2920
Па м3
2920
Па м3
Опыт №3.
T = 503К
-
СИ
PV
P1 =
 Па
ПаV1= 39,6 дм3

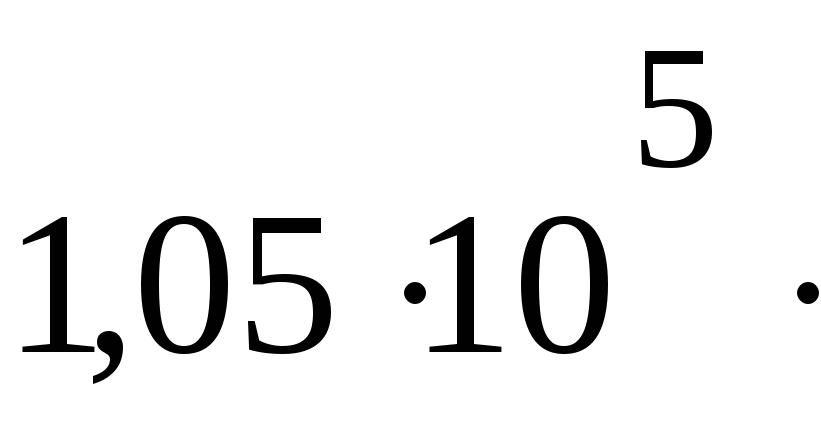
 4158
Па м3
4158
Па м3P2 =
 Па
ПаV2= 29,9 дм3


 4156
Па м3
4156
Па м3P3 =
 Па
ПаV3= 24,7 дм3


 4174
Па м3
4174
Па м3P4 =
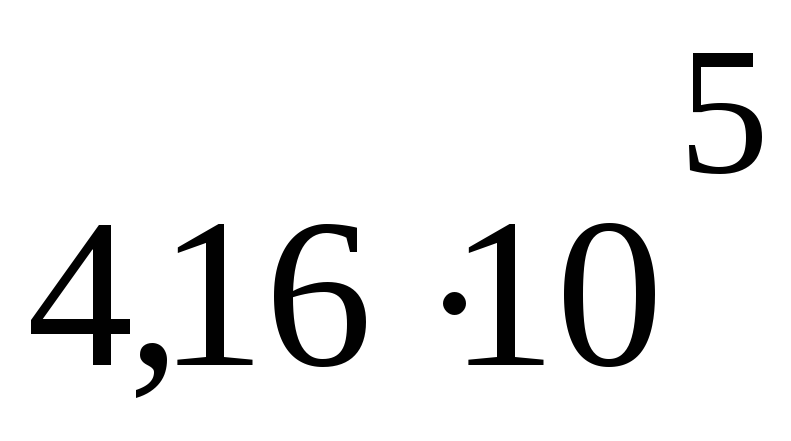 Па
ПаV4= 10 дм3


 4160
Па м3
4160
Па м3
PV
![]() 4158
Па м3
4158
Па м3
![]() 4156
Па м3
4156
Па м3
![]() 4174
Па м3
4174
Па м3
![]() 4160
Па м3
4160
Па м3
Расчетные задачи.
№1
-
Дано:
 =
1 моль
=
1 мольV=

P1 =
 Па
ПаT = 248 К
Решение
PV =
 R
T
R
TR = P V /
 T
TR =



R - ?
R = 8.10 Дж /

Ответ:
R
= 8,10
Дж
/
![]()
№2
-
Дано:
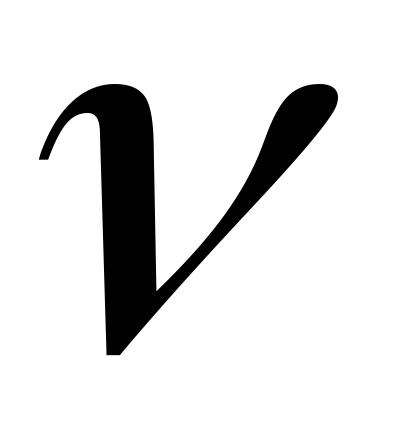 =
1 моль
=
1 мольPн =
 Па
ПаTн = 293 К
R = 8,31 м3Па /

Решение
PнVо =
 R
Tн
R
TнVо =
 R
Tн
/ Pн
R
Tн
/ PнVо = 8,31 м3Па /

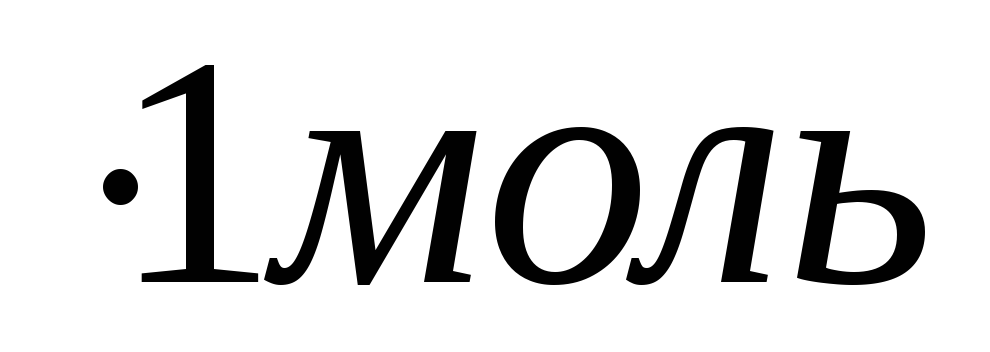
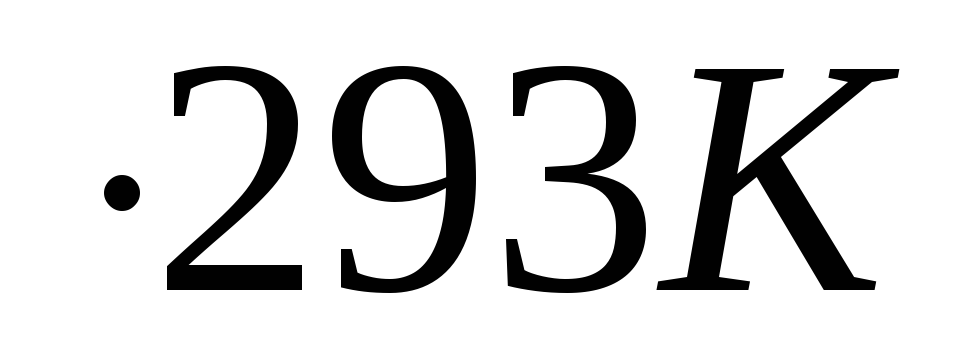 /105
Па
/105
ПаVо = 0,0243м3 = 24,3 дм3
Vо - ?
Ответ: Vо = 24,3 дм3
№3
-
Дано:
m= 16г
V= 10 дм3
P =
 Па
ПаT = 361 К
Си


Решение
PV = m R T / M
M = m R T / PV
M =


 /
/
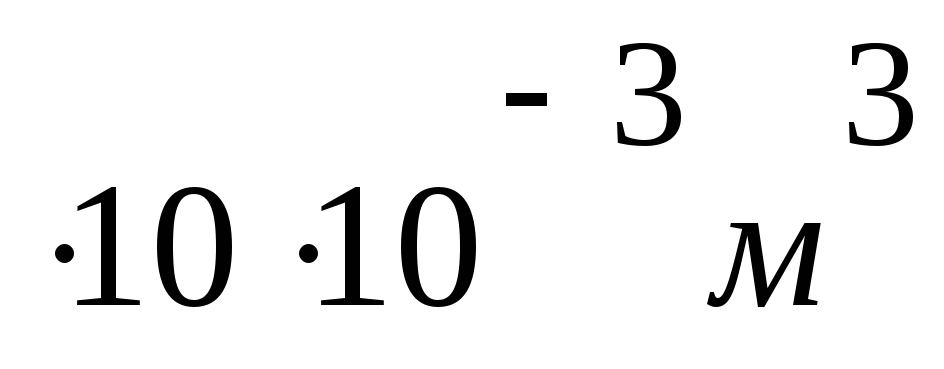
M= 0,024 кг / моль = 24 г / моль
R - ?
Ответ: М = 24 г / моль
№4
-
Дано:
T = const
 =
1 моль
=
1 мольM = 32

V1= 27 дм3
V2= 10 дм3
Q = 2490 Дж
Си


Решение
Т.к. T = const
 Q
=А =
Q
=А = V
(изменение внутренней энергии)
V
(изменение внутренней энергии)= m R T (V1 - V2)/ M
Т =
 V
/ (V R (V1
-
V2))
V
/ (V R (V1
-
V2))Т =2490Дж /(1моль
 8, 31Па
м3
/Кмоль
8, 31Па
м3
/Кмоль

 )
= 17625 К
)
= 17625 КТ - ?
Ответ: Т = 17625 К
Выводы:
1) Следили за параметрами идеального газа по графикам при различной температуре.
2) Отслеживали параметры P и V в заданных точках.
3) Доказали на расчетных данных справедливость законов Бойля-Мариотта.
Закон выполняется не точно, так как:
а) В опытах использовался неидеальный газ.
б) Ошибка измерительных приборов.
в) Ошибка при расчетах.
