
- •Аналитическая химия
- •Методические указания
- •Для студентов нехимических специальностей
- •Биологического и химико-технологического факультета
- •Раздел 1. Введение в аналитическую химию
- •Раздел 2. Метрологические основы аналитической химии
- •Раздел 3. Теоретические основы химических методов анализа
- •Раздел 4. Методы определения (количественный анализ). Химические методы
- •Раздел 5. Физико-химические методы анализа
- •Раздел 6.
- •Методические указания к выполнению лабораторных работ Лабораторная работа № 1 Качественный анализ катионов и анионов
- •Анализ смесей катионов
- •Анализ смесей анионов
- •Классификация катионов по кислотно-основной схеме
- •Групповые реакции анионов
- •Выполнение качественных реакций
- •Дробные реакции катионов
- •Анализ смеси анионов
- •Дробные реакции анионов
- •Лабораторная работа № 2 Определение содержания металлов в исследуемом растворе гравиметрическим методом Определение магния с 8-оксихинолином
- •Лабораторная работа № 3 Титриметрические методы анализа
- •1. Введение
- •2. Техника работы
- •1.1. Растворы, применяемые в титриметрии
- •Техника приготовления первичных стандартных растворов
- •2. Практические работы
- •Работа 2 Определение фосфорной кислоты
- •Выполнение определения
- •Лабораторная работа № 4 Окислительно-восстановительное титрование
- •Иодометрия
- •Определение меди
- •Выполнение определения
- •Лабораторная работа № 5 Комплексонометрическое титрование
- •Расчеты в комплексонометрическом титровании
- •Определение кальция и мaгния при совместном присутствии
- •Выполнение определения
- •Лабораторная работа № 6 Абсорбционная молекулярная спектроскопия
- •Фотометрические методы анализа
- •Законы поглощения электромагнитного
- •Определение железа (III) сульфосалициловой кислотой
- •Лабораторная работа № 7 Потенциометрическое титрование
- •Результаты точного титрования
- •Расчетный и графические способы обнаружения ктт
- •Кислотно-основное титрование
- •При их совместном присутствии
- •Лабораторная работа № 8 Потенциометрическое титрование.
- •Определение кобальта (II) в растворе
- •Выполнение определения
- •Лабораторная работа № 9 Кинетические методы анализа.
- •Определение меди (II) в растворах
- •Выполнение определения
- •Данные для приготовления растворов при построении градуировочного графика
- •Лабораторная работа № 10 Разделение смеси катионов металлов методом экстракции
- •Основные понятия
- •Количественные характеристики
- •Экстрагенты
- •Схемы разделения катионов методом экстракции Смесь катионов Cu (II), Zn (II), Mg(II), Mn (II), Аl (III)
- •1. Обнаружение и отделение Cu (II).
- •Марганца и алюминия
- •Лабораторная работа № 11 Разделение и обнаружение катионов и фенолов методом одномерной бумажной хроматографии.
- •Величины Rf. Некоторых катионов
- •Реагенты для обнаружения катионов на хроматограмме
- •IV. Варианты контрольных работ для студентов заочного отделения
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •Вариант № 6
- •Вариант № 7
- •Вариант № 8
- •Вариант № 10
- •Вариант № 14
- •Вариант № 15
- •Вариант № 18
- •Вариант № 20
- •V. Вопросы к экзамену
- •VI. Структура экзаменационного билета
- •VII. Рекомендуемая литература
Выполнение определения
К аликвоте (20 мл) испытуемого раствора в стакане для титрования прибавляют 10 мл раствора NH4Cl и 10 мл раствора NH4OH. Полученный раствор разбавляют до 60 – 70 мл.
Помещают стаканчик на магнитную мешалку, погружают в него электроды и выполняют ориентировочное титрование по 1 мл.
Проводят точное титрование новой порции раствора, прибавляя по 0,2 мл титранта в области КТТ.
Вычисляют содержание кобальта (г) в испытуемом растворе.
Лабораторная работа № 9 Кинетические методы анализа.
Определение меди (II) в растворах
В кинетических методах анализа аналитическим сигналом является скорость процессов, положенных в основу обнаружения или определения компонентов. Реакция, скорость которой при этом измеряется, называется индикаторной реакцией, а вещество, по изменению концентрации которого судят о скорости процесса, - индикаторным веществом. В качестве индикаторов чаще всего используют окислительно-восстановительные реакции, а для наблюдения за изменением индикаторного вещества во времени — люминесцентный или спектрофотометрический методы.
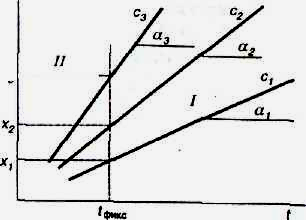
Рис.
1. Способы
тангенсов (/) и
фиксированного
времени
(II);
с -
концентрация
определяемого
компонента
,
c3>c3>ct
 сли
определяемым компонентом является
катализатор или связанные с ним соединения
- это каталитический вариант кинетического
метода (каталитический метод). Если в
некаталитической или каталитической
индикаторной реакции определяется одно
из реагирующих веществ - это некаталитический
вариант кинетических методов анализа.
Каталитические методы отличаются от
других методов химического анализа
высокой чувствительностью, а
некаталитический вариант кинетических
методов — высокой селективностью.
сли
определяемым компонентом является
катализатор или связанные с ним соединения
- это каталитический вариант кинетического
метода (каталитический метод). Если в
некаталитической или каталитической
индикаторной реакции определяется одно
из реагирующих веществ - это некаталитический
вариант кинетических методов анализа.
Каталитические методы отличаются от
других методов химического анализа
высокой чувствительностью, а
некаталитический вариант кинетических
методов — высокой селективностью.
Как найти содержание определяемого компонента по данным кинетических измерений? Как правило, для этого используют начальную скорость индикаторной реакции, когда зависимость между концентрацией индикаторного вещества (х) и временем реакции (t) прямолинейна. Чаще других применяют способ тангенсов или способ фиксированного времени (рис. 1). В способе тангенсов строят кинетические кривые в координатах: концентрация индикаторного вещества (х) или связанная с ней величина (А, lлюм) — время наблюдения (обычно измерения проводят через 1 мин, 1,5 мин, иногда 30 с). Тангенс угла наклона полученных прямых (tga) характеризует начальную скорость процесса. Для определения неизвестной концентрации компонента используют градуировочный график в координатах tga - концентрация определяемого компонента.
В способе фиксированного времени измеряют через определенное время (tфикс) (рис. 1) концентрации индикаторного вещества (-х,, х2, ..., х„) или связанные с ней величины (например, Ах, А2, ..., Ап). Градуировочный график строят в координатах х (или А), измеренное через tфикс - концентрация определяемого компонента.
Все приведенные ниже практические работы выполняются каталитическим методом, так как определяемым веществом является катализатор.
Внимание! При выполнении практических работ строго соблюдать указанный порядок смешения реагентов.
