
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Химия элементов. Свойсвта s-элементов и d-элемнтов I, II групп.
- •Водород, вода. Пероксид водорода
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства элементов iв группы: Cu, Ag, Au
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Элементы iiв группы: Zn, Cd, Hg
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Контрольные вопросы и задания
- •Индивидуальные задания
- •Исходные данные
- •1.4. Тестовые задания
- •Тема 2. Свойства элементов и соединений III - viiв групп.
- •2.1. Теоретические сведения
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства элементов viib группы. Марганец
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства оксидов и гидроксидов марганца
- •2.2. Контрольные вопросы и задания
- •2.3. Индивидуальные задания
- •Исходные данные
- •2.4. Тестовые задания
- •Тема 3. Свойства элементов viiib группы и их соединений
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •3.4. Тестовые задания
- •Тема 4. Свойства элементов и соединений III - iVa групп
- •4.1. Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Индивидуальные задания
- •Исходные данные
- •4.4. Тестовые задания
- •Тема 5. Свойства элементов и соединений vа группы
- •5.1. Теоретические сведения
- •Кислородные соединения азота.
- •Кислородсодержащие соединения фосфора
- •Атомные характеристики элементов
- •5.2. Контрольные вопросы и задания
- •5.3. Индивидуальные задания
- •Исходные данные
- •5.4. Тестовые задания
- •Тема 6. Свойства элементов и соединений vIa группы
- •6.1. Теоретические сведения
- •Природные источники элементов VI а группы
- •6.2. Контрольные вопросы и задания
- •6.3. Индивидуальные задания
- •Исходные данные
- •6.4. Тестовые задания
- •Тема 7. Элементы viIа группы. Благородеые газы
- •7.1. Теоретические сведения
- •Природные источники галогенов
- •Атомные характеристики элементов
- •Физико-химические свойства простого вещества
- •Физико-химические свойства галогеноводородов
- •Соединения галогенов с кислородом
- •Физико-химические свойства оксидов галогенов
- •Электродные потенциалы галогенов
- •Окислительно-восстановительные потенциалы хлора
- •Характеристика кислот
- •7.2. Контрольные вопросы и задания
- •7.3. Индивидуальные задания
- •Исходные данные
- •7.4. Тестовые задания
- •Программа дисциплины «общая и неорганическая химия» (первый и второй вопросы экзаменационных билетов)
- •Перечень практических вопросов (третий вопрос экзаменационных билетов)
- •Перечень тем типовых задач (четвертый вопрос экзаменационных билетов)
- •Критерии экзаменационной оценки «отлично»
- •«Хорошо»
- •«Удовлетворительно»
- •«Неудовлетворительно»
- •План общей характеристики группы элементов (атома элемента)
- •План характеристики элемента и его соединений
- •Перечень видеофильмов по изучаемым темам курса «общая и неорганическая химия»
- •Библиографический список
- •Оглавление
4.4. Тестовые задания
Электронное строение атома углерода 6С:
а) 1s22s22p2 в) 1s22s02p4
б) 1s22s12p3 г) 1s12s12p4
Тип гибритизации атома углерода в молекуле метана СН4:
а) sp б) sp2 в) sp3 г) sp2d
Дюралюминий – сплав алюминия содержащий:
а) 0,1-2% С, Si, Mn, S, P в) 4% Cu, 0,5% Mn, 0,5% Mg
б) 1,7% C, Si, Mn, S, P г) 18% Cr, 8% Ni
Уравнение, доказывающее кислотные свойства оксида алюминия:
а) Al2O3 + 3HOH = 2Al(OH)3
б) Al2O3 + 3KHSO4 = Al2(SO4)3 + 3KOH
в) Al2O3 + 2NaOH = 2NaAlO2 + HOH
г) Al2O3 + 6HCl = 2AlCl3 + 3HOH
8% массы земной коры составляет самый распространенный металл:
а) железо б) медь в) серебро г) алюминий
Природный оксид алюминия:
а) алюмосиликаты б) полевой шпат в) пирит г) глинозем
Соль, подвергающаяся необратимому гидролизу:
а) AlCl3 б) Al2(SO4)3 в) Al(NO3)3 г) Al2S3
Соль, кипячение раствора которой в алюминиевом сосуде приводит к разрушению последнего:
а) KNO3 б) KCl в) Na2CO3 г) NaCl
Кварц, горный хрусталь:
а) CaCO3 б) CaCO3 · MgCO3 в) Al2O3·2SiO2·2H2O г) K2O·Al2O3·6SiO2
Уравнение, характеризующее окислительные свойства углерода:
а) С + О2 = СО2 в) 2С + Са = СаС2
б) 2С + О2 = 2СО г) С + CuO = CO2 + Cu
Уравнение качественной реакции обнаружения угольной кислоты:
а) СО2 + 2Mg = 2MgO + C в) 2C + Ca = CaC2
б) СО + CuO = CO2 + Cu г) СО2 + ВаСО3 + Н2О
Формула питьевой соды:
а) Na2SiO3 б) Na2CO3 в) NaHCO3 г) CaCO3
Уравнение лабораторного синтеза кремния:
а) 2Mg + SiO2 = 2MgO + Si в) H2SiO3 = H2O + SiO2
б) SiO2 + CaCO3 = CaSiO3 + CO2 г) SiO2 + 2C = Si + 2CO
Уравнение получения кремния в промышленности:
а) 2Mg + SiO2 = 2MgO + Si в) H2SiO3 = H2O + SiO2
б) SiO2 + CaCO3 = CaSiO3 + CO2 г) SiO2 + 2C = Si + 2CO
Формула силана:
а) SiH4 б) SiC в) Si3N4 г) Mg2Si
Структура кристаллического кремния аналогична структуре соединения:
а) графита б) алмаза в) карбина г) красного фосфора
Тема 5. Свойства элементов и соединений vа группы
![]() Библиографический
список: [2, c.
471–492, конспект лекций]
Библиографический
список: [2, c.
471–492, конспект лекций]
5.1. Теоретические сведения
р-элементы азот, фосфор, мышьяк, сурьма и висмут занимают главгую подгруппу V группы.
В наружной электронной оболочке атомы этих элементов содержат пять электронов, которые имеют следующую электронную формулу: ns2np3 и распределены следующим образом:
ns np









Наличие трех неспаренных электронов в наружной электронной оболочке говорит о том, что в нормальном, невозбужденном состоянии атомы элементов главной подгруппы имеют валентоность III.
В возбужденном состоянии один из s-электронов внешнего слоя переходит на свободную d-орбиталь, что приводит к образованию пяти неспаренных электронов:
ns np nd
|
|
|
| |||||
|---|---|---|---|---|---|---|---|
|
|
|
|
| ||||
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
Таким образом, для элементов Vа группы в возбужденном состоянии валентность равна V. Исключением является азот, ввиду отсутствия у него d-подуровня. Элементы данной подгруппы проявляют степени окислении: -3, -1, 0, +1, +3, +5.
С водородом азот, фосфор и мышьяк образуют полярные соединения типа RН3, проявляя отрицательную степень окисления. С более электроотрицательными элементами, например, с кислородом, они образуют оксиды типа R2О5, проявляя тем самым высшую положительную степень окисления (+5).
Это более активные металлоиды, чем четвертая группа. Сверху вниз по подгруппе увеличивается радиусы атомов и ионов, а ионизационные потенциалы уменьшаются, поэтому, увеличиваются металлические и восстановительные свойства. У сурьмы и висмута металлические свойства превалируют над неметаллическими. Наиболее характерным неметаллом относят азот.
Азот составляет около 4/5 атмосферы воздуха, которая состоит на 78,2% из азота, 21% кислорода и 1% инертных газов. Он также входит в состав минералов: NaNO3- чилийской селитры и KNO3 – индийской селитры.
Электронная конфигурация азота: 1s2 2s2 2p3

 2s
2p
2s
2p









Особенности строения атомов азота N и молекул азота N2:
Атом азота содержит три неспаренных электрона, которые могут участвовать в образовании трех ковалентных связей.
Атом азота имеет четыре валентные орбитали, которые могут находиться в sp3 sp2 sp - гибридном состоянии. Отсюда, его ковалентность равна 4
Атомы азота друг с другом образуют 3 ковалентных связи: одну σ и две π:

Поэтому молекула N2 –прочна, химически малоактивна (инертна), все реакции с N2 протекают при T>1000 C. Молекула азота не имеет электрического дипольного момента (связь в ней неполярна), между молекулами азота действуют слабые дисперсионные силы Ван-дер-Ваальса, что является причиной низких температур кипения и плавления, и малой растворимости в воде.
N2 – инертный газ без запаха и вкуса, мало растворим в воде.
В промышленности азот получают фракционной перегонкой (испарение жидкого воздуха) при Ткип = -195,8оC и Tкип = -183о C , при этом раньше испаряется азот, а кислород остается. Азот собирают в баллонах при высоком давлении.
В лаборатории азот чаще всего получают термическим разложением солей аммония:
NH4NO2 → N2 + 2H2 O
(NH4)2Cr2O7= N2 + Cr2O3+ 4H2O
И пропусканием воздуха над раскаленной медью:
2N2 + O2 + 2Cu = 2 CuO + 4N2
При обычных условиях азот реагирует только с литием:
6Li + N2 = 2Li3N
При нагревании азот взаимодействует и с другими металлами, образуя нитриды:
3Mg + N2 = Mg3+2 N2-3
При очень высокой температуре взаимодействует с кислородом, хлором и фтором:
N 2
+ O2
эл.
заряд
NO
2
+ O2
эл.
заряд
NO
F2 + N2 → NF3
Cl2 + N2→ NCl3
При оптимальных условиях (t = 4500С и Р=1000 атм) взаимодействует с водородом, образуя аммиак:
N2 + 3H2 → 2NH3
Водородные соединения азота - нитрид азота – H3N или аммиак - NH3 (азот имеет степень окисления -3) в промышленности получают путем взаимодействия азота с водородом:
N2 + 3H2 = 2NH3
В лаборатории - путем взаимодействия хлорида аммония с основаниями:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
Атом азота в NH3 (H3N) находится в sp3 гибридном состоянии, на четвертой орбитали находится неподеленная пара электронов; валентный угол H-N-H составляет 107о, близок к тетраэдрическому (рис. 7).
NH3 - бесцветный газ, с сильным запахом, хорошо растворим в воде.

Рис. 7. Строение молекулы аммиака.
Наличие заряда на атоме водорода и неподеленной пары электронов у атома азота объясняются следующие особенности химических свойств аммиака:
1. Способность отщеплять и присоединять ион H+ (протон):
2
 NH
3
NH
4
+
+ NH2-
NH
3
NH
4
+
+ NH2-
катион аммония амид ион
2. Гидроксид аммония - NH3∙H2O - слабое основание (Kb = 1,8∙10-5) образуется по донорно-акцепторному механизму:
N




 H3
+ HOH NH3∙HOH
NH4
+
+ OH -
t
NH3
+ H2O
H3
+ HOH NH3∙HOH
NH4
+
+ OH -
t
NH3
+ H2O
В водных растворах NH3 существует виде трехмерной структуры, то есть молекула аммиака окружена водой:
 H
H




 H-O:
H N : H O:
H-O:
H N : H O:


H H H
Аналогично взаимодействие NH3 с образованием солей:
NH3 + HCl = NH4Cl - хлорид аммония
(по донорно - акцепторному механизму).
Соли аммония – белые кристаллические вещества. Хорошо растворимы в воде, подвергаются гидролизу:
NH4Cl + HOH = NH3∙H2O + HCl
слабое сильная
основание кислота
Соли аммония при нагревании легко разлагаются:
(NH4)2CO3 = NH3 + NH4 HCO3
При взаимодействии со щелочью соли аммония легко вступают в реакцию обмена, при этом выделяется аммиак:
NH4Cl + NaOH = NH3∙H2O + H2O
Две последние реакции являются качественными на соли аммония.
3. Связь N-H в молекуле NH3 – ковалентная полярная, что объясняет возможность замещения атомов водорода на различные заместители:
- замещение на электроположительные заместители
2NH3 + Na =t= 2NaNH2 + H2
4NaNH2 =t= 2 Na2NH + 2NH3
амид натрия
3Na2NH =t= 2Na3N + NH3
нитрид натрия
Эти реакции указывают на то, что аммиак обладает кислотными свойствами.
- замещение на электроотрицательный заместитель
NH3 + Cl2 = NH2Cl + HCl
хлорамин
4. Наличием неподеленной пары электронов у атома азота можно объяснить способность его к комплексообразованию по донорно-акцепторному механизму:
Cu2+ + 4NH3 = [Cu (NH3)4] 2+
5. Степень окисления азота в аммиаке равна -3, поэтому он -слабый восстановитель:
4NH3 + 5O2 =kat= 4NO + 6H2O
4NH3 + 3O2 = 2N2↑ + 6H2O
3CuO + 2NH3 = N2↑ + 2Cu + 3H2O
NH 4NO3 = N2O + 2H2O
Если соль образована сильной кислотой, то продуктом разложения соли является оксид:
NH4NO3 = N2O + 2H2O
Если соль образована слабой кислотой, то продуктом является N2:
NH4NO2 == N2↑+ 2H2O
Таким образом, жидкий аммиак – сильный ионизирующий растворитель. Так, производные аммония NH4+(NH4Cl) в жидком аммиаке ведут себя как кислоты, а производные NH2- (амиды) – как основания.
Гидразин N2H4 (пернитрид водорода) бесцветная жидкость

 H
.. .. H
H
.. .. H

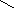 N
– N
Валентность азота равна
трём,
N
– N
Валентность азота равна
трём,
H H степень окисления -2
Гидразин можно представить как производное аммиака, в котором один водород замещен группой –NH2.
Получают гидразин путем окисления аммиака гипохлоритом натрия:
2H3N+NaClO = N2H4 + NaCl + H2O
Химические свойства гидразина:
N2H4 + HOH = N2H5++ OH- - донорно -акцепторный механизм:
ион гидразиния
2. N2H4 + O2 = N2 +2 H2O
3. N2H4 + HCl = [N2H5]+ + Cl-
4. N2H4 + CuSO4 = [Cu(N2H4)4]SO4
5. N2H4 – сильный восстановитель:
4KMnO4 +5N2H4 + 6 H 2SO4 = 5 N2 + 4MnSO4 + 2K2SO4 + 16H2O
Гидроксиламин NH2-OH – белое кристаллическое вещество, хорошо растворимо в воде.
 H
..
H
..


 N
O H
Валентность азота равна III,
N
O H
Валентность азота равна III,
H степень окисления азота -1
Получают восстановлением раствора HNO3 атомарным водородом:
HNO3 + 6 H = NH2OH + 2H2O
Характерны реакции присоединения H+ по донорно – акцепторному механизму:
NH2OH + HCl = [NH3OH]+ Cl-
ион – гидроксоламминия
NH2OH +H2O = [NH3OH]+ OH –
NH2OH + CuSO4 = [Cu(NH2OH)4]SO4
Гидроксиламин проявляет окислительные и восстановительные свойства. В кислой среде он окислитель, в щелочной - сильный восстановитель:
2NH2OH + HOCl = N2 + HCl + 3H2O
2NH2OH – 2е → N2 + 2Н2О + 2Н+ - восстановитель, процесс окисления
HOCl + 2е → Cl- + ОН- - окислитель, процесс восстановления
2NH4OH + J2 + 2KOH = N2 + 2KJ + 4H2O
2NH2OH – 2е+ 2ОН- → N2 + 4Н2О - восстановитель, процесс окисления
I2 + 2e → 2I- - окислитель, процесс восстановления
2NH2OH + 4FeSO4 + 3H2SO 4 = 2Fe2(SO4)3 + (NH4)2 SO4 + 2H2O
NH2OH + 2е + 3Н+ → NH4+ + Н2О – окислитель, процесс восстановления
2Fe2+ - 2е → 2Fe – восстановитель, процесс окисления
NH2 OH легко разлагается по механизму самоокисления – самовосстановления (реакция диспропорционирования), является и окислителем и восстановителем:
2NH2OH = NH3 + N2o + 3H2O
Нитриды, соединения N2 с Me:
3Mg + N2 = Mg3+2 N2-3
2Al + N2 = 2AlN
Азотистоводородная кислота – HN3 H – N3- = N5+ ≡ N3-
Получение: N2H4 + HNO2 = 2H2O + HN3↑
По силе азотистоводородная кислота близка к уксусной, а по растворимости солей (азидов) похожа на соляную кислоту. HN3 – окислитель:
3HNN2 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
Свойства кислородсодержащих соединений азота приедставлены в табл. 18.
Таблица 18





