
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Химия элементов. Свойсвта s-элементов и d-элемнтов I, II групп.
- •Водород, вода. Пероксид водорода
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства элементов iв группы: Cu, Ag, Au
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Элементы iiв группы: Zn, Cd, Hg
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Контрольные вопросы и задания
- •Индивидуальные задания
- •Исходные данные
- •1.4. Тестовые задания
- •Тема 2. Свойства элементов и соединений III - viiв групп.
- •2.1. Теоретические сведения
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства элементов viib группы. Марганец
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства оксидов и гидроксидов марганца
- •2.2. Контрольные вопросы и задания
- •2.3. Индивидуальные задания
- •Исходные данные
- •2.4. Тестовые задания
- •Тема 3. Свойства элементов viiib группы и их соединений
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •3.4. Тестовые задания
- •Тема 4. Свойства элементов и соединений III - iVa групп
- •4.1. Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Индивидуальные задания
- •Исходные данные
- •4.4. Тестовые задания
- •Тема 5. Свойства элементов и соединений vа группы
- •5.1. Теоретические сведения
- •Кислородные соединения азота.
- •Кислородсодержащие соединения фосфора
- •Атомные характеристики элементов
- •5.2. Контрольные вопросы и задания
- •5.3. Индивидуальные задания
- •Исходные данные
- •5.4. Тестовые задания
- •Тема 6. Свойства элементов и соединений vIa группы
- •6.1. Теоретические сведения
- •Природные источники элементов VI а группы
- •6.2. Контрольные вопросы и задания
- •6.3. Индивидуальные задания
- •Исходные данные
- •6.4. Тестовые задания
- •Тема 7. Элементы viIа группы. Благородеые газы
- •7.1. Теоретические сведения
- •Природные источники галогенов
- •Атомные характеристики элементов
- •Физико-химические свойства простого вещества
- •Физико-химические свойства галогеноводородов
- •Соединения галогенов с кислородом
- •Физико-химические свойства оксидов галогенов
- •Электродные потенциалы галогенов
- •Окислительно-восстановительные потенциалы хлора
- •Характеристика кислот
- •7.2. Контрольные вопросы и задания
- •7.3. Индивидуальные задания
- •Исходные данные
- •7.4. Тестовые задания
- •Программа дисциплины «общая и неорганическая химия» (первый и второй вопросы экзаменационных билетов)
- •Перечень практических вопросов (третий вопрос экзаменационных билетов)
- •Перечень тем типовых задач (четвертый вопрос экзаменационных билетов)
- •Критерии экзаменационной оценки «отлично»
- •«Хорошо»
- •«Удовлетворительно»
- •«Неудовлетворительно»
- •План общей характеристики группы элементов (атома элемента)
- •План характеристики элемента и его соединений
- •Перечень видеофильмов по изучаемым темам курса «общая и неорганическая химия»
- •Библиографический список
- •Оглавление
Тема 3. Свойства элементов viiib группы и их соединений
![]() Библиографический
список: [1, с. 276–284; 2; 3, с. 349–352]
Библиографический
список: [1, с. 276–284; 2; 3, с. 349–352]
3.1. Теоретические сведения
Общая характеристика. Элементы VIIIB группы образуют триады d-элементов, расположенные в середине больших периодов: железо(Fe), кобальт (Co), никель (Ni) – в четвертом; рутений (Ru), родий (Rh), палладий (Pd) – в пятом; осмий (Os), иридий (Ir), платина (Pt) – в шестом.
Fe, Co, Ni, очень близкие по свойствам, образуют семейство (триаду) железа; Ru, Rh, Pd, Os, Ir, Pt объединяют в семейство платиновых металлов.
На s-орбиталях внешнего слоя атомы всех девяти элементов содержат не более двух электронов, поэтому для них характерно проявление металлических свойств. Высшая степень окисления +8, отвечающая номеру группы периодической системы, проявляется лишь у Ru и Os (в высших оксидах RuO4 и OsO4) – у остальных элементов степени окисления, как правило, не выше +6.
Характерные степени окисления для железа: +2 (соли Fe+2), +3 (соли Fe+3), +6 (соли H2FeO4); для кобальта: +2 (соли Со+2), +3 (комплексы Со+3); для никеля: +2 (соли Ni+2), +3 (Ni(OH)3). Атомные характеристики элементов приведены в табл. 14.
В атоме железа два парных s- и 4 неспаренных d-электрона. Из двух s-электронов при возбуждении атома один переходит в p-состояние (Fe*):
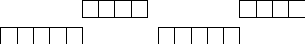 4s
4р
4s 4р
4s
4р
4s 4р
3d 3d
Fe Fe*
– реализуется наивысшая степень окисления железа +6.
У Co, Rh и Ir, а также Ni, Pd, Pt происходит дальнейшее спаривание d-электронов и стабилизация d-подуровня:
 4s
4р
4s
4р
4s
4р
4s
4р
3d 3d
Co Ni
Атомы Fe, Co, Ni легче всего отдают по два электрона наружного электронного слоя с образованием соединений со степенью окисления +2. При образовании соединений со степенью окисления больше +2 принимают участие электроны 3d-подуровня.
Ион Fe3+ легко образуется, вероятно, вследствие повышенной стабильности наполовину заполненной d-оболочки (d5 – конфигурация иона Fe3+).
Таблица 14
Атомные характеристики элементов
|
Элемент |
Fe |
Со |
Ni |
|
Атомный номер |
26 |
27 |
28 |
|
Ковалентный радиус, нм |
0,117 |
0,116 |
0,115 |
|
Металлический радиус, нм |
0,126 |
0,125 |
0,124 |
|
Радиус иона, нм Э2+ Э3+ |
0,078 0,065 |
0,076 0,061 |
0,069 0,060 |
|
Электроотрицательность |
1,64 |
1,70 |
1,75 |
|
Первый потенциал ионизации, В |
7,893 |
7,866 |
7,635 |
|
Степени окисления (выделены наиболее устойчивые) |
+2,+3,+6 |
+2,+3 |
+2,+3,+4 |
Элементы Fe, Ru, Os, а также Co, Rh, Ir и Ni, Pd, Pt являются электронными аналогами и близки между собой по свойствам. Вследствие лантаноидного сжатия особо близки свойства пар Ru – Os, Rh – Ir, Pd – Pt.
По мере заполнения (n–1)d – орбиталей вторым электроном усиливается также сходство соседних d-элементов по периоду.
Так, Fe проявляет сходство с Mn, a Ni проявляет большое сходство как с Со и Fe, так и с Cu.
Железо, кобальт, никель – серебристо-серые металлы, тугоплавкие, тяжелые. Они обладают превосходными механическими свойствами, образуют многочисленные сплавы друг с другом, с другими металлами – Cr, Mn, Mo и с неметаллами. Нержавеющие стали используют для изготовления медицинских инструментов, химической аппаратуры.
В природе железо, кобальт и никель редко встречаются в свободном состоянии (только в метеоритах) и широко распространены в виде соединений (оксидов, сульфидов, карбонатов, арсенидов, силикатов). Основные физико-химические свойства данных металлов представлены в табл. 15.
Таблица 15
