
Закон Гесса
В 1840 г. Г.И.Гесс опытным путём установил один из основных законов термохимии: изохорный и изобарный тепловой эффект реакции не зависит от пути протекания реакции, т.е. от числа промежуточных стадий, через которые происходит превращение исходных веществ в продукты реакции, а зависит от состояния исходных веществ и продуктов реакции.

I С(т) + О2(г)
СО2(г)
; Н
= –393 кДж
С(т) + О2(г)
СО2(г)
; Н
= –393 кДж
II С(т) + ½О2(г) СО (г); Н1 = –110 кДж
СО(г) + ½О2(г) СО2(г); Н2 = –283 кДж
Н = Н1 + Н2
Как видно, тепловой эффект первого процесса равен суммарному тепловому эффекту второго процесса
Стандартная энтальпия образования вещества (Н0обр) – тепловой эффект реакции образования 1 моль сложного вещества из простых веществ при стандартных условиях (Т=298К, Р=1атм). Стандартная энтальпия образования простых веществ равна нулю.
Стандартная энтальпия сгорания вещества (Н0сг) – тепловой эффект реакции сгорания 1 моль сложного вещества с образованием высших оксидов. Стандартная энтальпия сгорания высших оксидов и кислорода равна нулю.
Следствия из закона Гесса
1. Энтальпия образования вещества равна энтальпии разложения вещества, но противоположна по знаку (закон Лавуазье–Лапласа): Нобр = –Нразл. Например, энтальпия образования оксида кальция из металлического кальция и газообразного кислорода равна:
Са(г) + 1/2О2(г) = СаО(г); Н = – 636,4 кДж
Для разложения 1 моль оксида кальция на кальций и кислород необходимо затратить 636,4 кДж:
СаО(г) = Са(т) + 1/2О2(г); Н = 636,4 кДж
2. Тепловой эффект реакции равен сумме стандартных энтальпий образования продуктов реакции минус сумма стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов уравнения реакции.
Н0реакции = Н0обр.прод. — Н0обр.исх. в–в
Данное уравнение даёт возможность рассчитать тепловой эффект любой реакции, когда известны стандартные теплоты образования продуктов реакции и исходных веществ.
3. Тепловой эффект реакции равен сумме стандартных энтальпий сгорания исходных веществ минус сумма стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов уравнения реакции.
Н0реакции = Н0сг.исх. — Н0сг.прод.
Тепловые эффекты различных процессов
1. Теплота растворения – это количество энергии, которое выделяется или поглощается при растворении 1 моля вещества в количестве растворителя, достаточном для полной сольватации (на 1 моль вещества 300 – 400 молей растворителя).
Теплота растворения равна сумме двух слагаемых:
Нрастворения = Н1 + Н2
где Н1 – теплота перехода твердого или газообразного вещества в то состояние, в котором оно существует в растворе.
Н2 – теплота взаимодействия растворяемого вещества с растворителем (теплота сольватации или теплота гидратации, если растворителем является вода).
Н2 всегда отрицательна, а Н1 может быть и положительна и отрицательна.
П
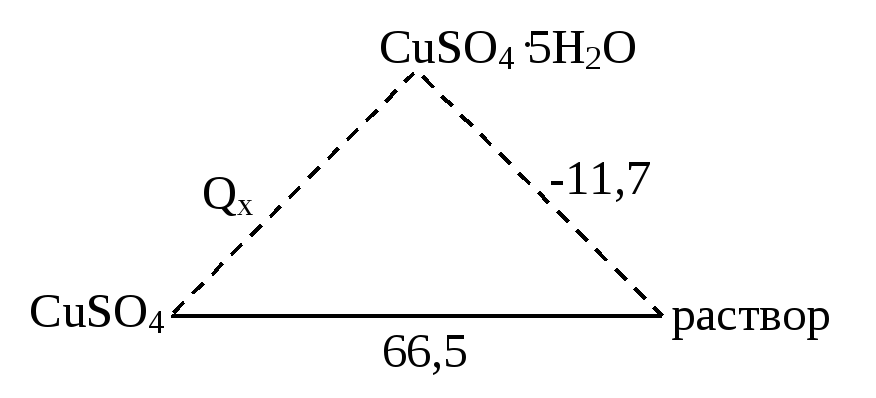
66,5 = Qx –11,7.
Отсюда: Qх = + 78,2 кДж; Н = –78,2кДж
2. Теплота нейтрализации – это количество энергии, которое выделяется при образовании одного моля воды из Н+ (Н3О+) и ОН– при стандартных условиях:
NaOH + HCl = NaCl + H2O или
H+(aq) + OH–(aq) = H2O(ж) + 56,98 кДж
При взаимодействии сильной кислоты и сильного основания, независимо от их природы, теплота нейтрализации будет постоянной и равна 56,98 кДж.
Если в реакцию вступает слабая кислота или слабое основание, то теплота нейтрализации будет меньше, так как ионизация кислоты (основания) потребует затраты энергии.
HCN + NaOH = NaCN + H2O + Q
HCN + OH– = CN– + H2O + Q; Q < 56,98 кДж
3. Теплота фазовых превращений – это количество энергии, которое выделяется или поглощается в процессе перехода компонентов системы из одной фазы в другую.
Пример. Вычислить тепловой эффект перехода Si (аморфный) Si (кристаллический), если теплоты сгорания этих модификаций составляют 867,3 и 850,6 кДж соответственно. Аморфный кремний можно сразу окислить до SiO2:
Si(ам) + О2 =SiO2 + 867,3 кДж, а можно сначала превратить его в кристаллическую модификацию, которую затем подвергнуть окислению.
1. Si (ам) = Si (крист.) + Qx
2. Si (крист.) + О2 = SiO2 + 850,6 кДж
867,3 – 850,6 = 16,7 кДж
Н = – 16,7 кДж
Фаазовый переход (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Наиболее часто рассматриваются фазовые переходы при изменении температуры, но при постоянном давлении (как правило равном 1 атмосфере). Именно поэтому часто употребляют термины «точка» (а не линия) фазового перехода, температура плавления и т. д. Разумеется, фазовый переход может происходить и при изменении давления, и при постоянных температуре и давлении, но при изменении концентрации компонентов (например, появление кристалликов соли в растворе, который достиг насыщения).
Классификация фазовых переходов
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Подчеркнём: имеется в виду скачкообразное изменение этих величин при изменении температуры, давления и т. п., а не скачкообразное изменение во времени (насчёт последнего см. ниже раздел Динамика фазовых переходов).
Наиболее распространённые примеры фазовых переходов первого рода:
плавление и кристаллизация
испарение и конденсация
сублимация и десублимация
При фазовом переходе второго рода плотность и внутренняя энергия не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д.
Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться). Описание фазового перехода второго рода как следствие изменения симметрии даётся теорией Ландау. В настоящее время принято говорить не об изменении симметрии, но о появлении в точке перехода параметра порядка, равного нулю в менее упорядоченной фазе и изменяющегося от нуля (в точке перехода) до ненулевых значений в более упорядоченной фазе.
Наиболее распространённые примеры фазовых переходов второго рода:
прохождение системы через критическую точку
переход парамагнетик-ферромагнетик или парамагнетик-антиферромагнетик (параметр порядка —намагниченность)
переход металлов и сплавов в состояние сверхпроводимости (параметр порядка — плотность сверхпроводящего конденсата)
переход жидкого гелия в сверхтекучее состояние (п.п. — плотность сверхтекучей компоненты)
переход аморфных материалов в стеклообразное состояние
Современная физика исследует также системы, обладающие фазовыми переходами третьего или более высокого рода.
В последнее время широкое распространение получило понятие квантовый фазовый переход, т.е. фазовый переход, управляемый не классическими тепловыми флуктуациями, а квантовыми, которые существуют даже при абсолютном нуле температур, где классический фазовый переход не может реализоваться вследствие теоремы Нернста.
Динамика фазовых переходов
Как сказано выше, под скачкообразным изменением свойств вещества имеется в виду скачок при изменении температуры и давления. В реальности же, воздействуя на систему, мы изменяем не эти величины, а её объем и её полную внутреннюю энергию. Это изменение всегда происходит с какой-то конечной скоростью, а значит, что для того, чтобы «покрыть» весь разрыв в плотности или удельной внутренней энергии, нам требуется некоторое конечное время. В течение этого времени фазовый переход происходит не сразу во всём объёме вещества, а постепенно. При этом в случае фазового перехода первого рода выделяется (или забирается) определённое количество энергии, которая называется теплотой фазового перехода. Для того, чтобы фазовый переход не останавливался, требуется непрерывно отводить (или подводить) это тепло, либо компенсировать его совершением работы над системой.
В результате, в течение этого времени точка на фазовой диаграмме, описывающая систему, «замирает» (т.е. давление и температура остаются постоянными) до полного завершения процесса.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Латыпов Р.Ш., Шарафиев Р.Г. Техническая термодинамика и энерготехнология химических производств.-М.:Энергоатомиздат, 1998.-344 с.
Баскаков А.П. Теплотехника.-М.:Энергоатомиздат, 1991.-244 с.
Алабовский А.Н., Константинов С.М., Недужий А.Н. Теплотехника.-Киев: Выща Школа, Головное издательство, 1986.-255 с.
Александров А.А., Григорьев Б.А. Таблицы теплофизических свойств воды и водяного пара. Справочник.-М.: Издательство МЭИ, 1994.- 168 с.
Лариков Н.Н. Теплотехника: Учебник для вузов. -3-е изд., перераб. и дополн.-М.; Стройиздат, 1985 -432 с.ил.
