
- •1. Калориметрія
- •Виконання роботи
- •2. Хімічна рівновага
- •Виконання роботи
- •3. Визначення молярної маси леткої рідини
- •Виконання роботи
- •4. Тиск насиченої пари рідини
- •Виконання роботи
- •5. Кріоскопія
- •Виконання роботи
- •6. Термічний аналіз
- •Виконання роботи
- •7. Рідини, що обмежено розчиняються
- •Виконання роботи
- •8. Коефіцієнт розподілу
- •Виконання роботи
1. Калориметрія
Хімічні реакції, процеси розчинення, зміни агрегатного стану речовини супроводжуються виділенням або поглинанням теплоти.
Тепловий ефект розчинення кристалічної речовини у воді або в іншому розчиннику є сумою двох складових: теплоти руйнування кристалічної решітки та теплоти гідратації (в загальному випадку – сольватації) іонів.
|
|
(1.1) |
Оскільки
![]() завжди додатна (на руйнування кристалічної
решітки потрібно витратити енергію), а
завжди додатна (на руйнування кристалічної
решітки потрібно витратити енергію), а![]() завжди від’ємна, знак
завжди від’ємна, знак![]() визначається співвідношенням абсолютних
величин
визначається співвідношенням абсолютних
величин![]() та
та![]() :
:
|
|
(1.2) |
Тому, якщо речовина легко гідратується, її розчинення супроводжується виділенням теплоти (наприклад CuSO4, BaCl2), а якщо гідратація незначна – поглинанням теплоти (КСl, К2SО4). Розчинення кристалогідратів, насичених водою, також супроводжується поглинанням теплоти.
Інтегральною теплотою розчинення кристалічної речовини називається кількість теплоти, що виділяється або поглинається внаслідок розчинення одного моля речовини в такій кількості розчинника, при якій утворюється розчин певної концентрації. Інтегральна теплота розчинення залежить від природи розчиненої речовини, розчинника, концентрації розчину та температури.
Теплові ефекти визначають за допомогою калориметрів. Найпростіший калориметр – це склянка, яка повністю, або частково ізольована від довкілля. При дослідженні процесу розчинення твердої речовини в склянку занурюють термометр, скляну паличку-мішалку та наливають певну кількість розчинника.
Тепловий ефект процесу, який перебігає у калориметрі, можна розрахувати за допомогою рівняння
|
|
(1.3) |
де
![]() - теплоємність калориметра,ΔТ
– зміна температури в результаті
розчинення.
- теплоємність калориметра,ΔТ
– зміна температури в результаті
розчинення.
Теплоємністю калориметра називається кількість теплоти, яка необхідна для нагрівання його на один градус. Теплоємність калориметра розраховується як сума теплоємностей його окремих частин, тобто склянки, мішалки, термометра та розчину:
|
|
(1.4) |
де сі
– питома теплоємність матеріалу
складової частини калориметра,
![]() ;gі
–
маса складової частини калориметра, г.
;gі
–
маса складової частини калориметра, г.
Виконання роботи
Мета роботи: визначити теплоємність калориметра та тепловий ефект розчинення кристалічної речовини.
1. Визначення теплоємності калориметра.
Як калориметр використовується поліетиленовий стакан, який частково теплоізольований від довкілля. Схему калориметра наведено на рис. 1.
Д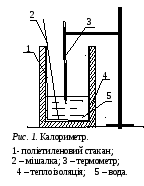 ля
визначення теплоємності калориметра
на технічних терезах зважують
поліетиленовий стакан та скляну паличку.
Відміряють мірним циліндром 200 мл
дистильованої води та виливають її в
стакан.
Підвішують
термометр, відмічають глибину його
занурення у воду і за допомогою мірного
циліндра визначають об’єм витісненої
води, який дорівнює об’єму зануреної
частини термометра.
ля
визначення теплоємності калориметра
на технічних терезах зважують
поліетиленовий стакан та скляну паличку.
Відміряють мірним циліндром 200 мл
дистильованої води та виливають її в
стакан.
Підвішують
термометр, відмічають глибину його
занурення у воду і за допомогою мірного
циліндра визначають об’єм витісненої
води, який дорівнює об’єму зануреної
частини термометра.
Результати вимірів записують у таблицю 1.1.
Таблиця 1.1 – Маси складових частин калориметра та питомі теплоємності матеріалів.
|
Складові частини калориметра |
Поліетиленовий стакан |
Скляна паличка |
Вода |
Об’єм зануреної частини термометра |
|
Маса складової частини g, г |
|
|
200 |
|
|
Питомі
теплоємності матеріалів,
|
2,3 |
0,79 |
4,18 |
1,9
|
Розраховують
теплоємність калориметра згідно з
формулою (1.4),
![]() :
:
![]() .
.
2. Визначення інтегральної теплоти розчинення солі.
На технічних терезах зважують 5 г розтертої в ступці солі.
Зміну температури внаслідок процесу розчинення визначають таким чином. При перемішуванні води в склянці декілька разів вимірюють температуру через рівні проміжки часу (15 с) поки не отримають три однакових значення (t1). Після цього у воду всипають сіль і енергійно перемішують розчин до повного розчинення солі, продовжуючи виміри температури до того часу, поки не отримають три однакові значення температури розчину (t2). Виміряні температури записують у таблицю 1.2.
Таблиця 1.2 – Зміна температури в процесі розчинення кристалічної речовини.
|
τ, с |
|
|
|
|
|
|
|
|
|
t, 0С |
|
|
|
|
|
|
|
|
Зміну температури визначають за формулою:
![]() .
.
Інтегральну
теплоту розчинення солі розраховують
за рівнянням,
![]() :
:
|
|
(1.5) |
де М
– молярна маса солі,
![]() ;g
– маса наважки солі, г.
;g
– маса наважки солі, г.
Розрахована за формулою (1.5) інтегральна теплота розчинення - практичне значення. Її теоретичне значення наводиться у довіднику для розчинів різних моляльних концентрацій.
Моляльна
концентрація – це кількість молів
розчиненої речовини в 1 кг розчинника
![]() .
Оскільки розчинником є вода, маса якої
складає 0,2 кг (200 мл), то формула для
розрахунку моляльної концентрації буде
мати вигляд:
.
Оскільки розчинником є вода, маса якої
складає 0,2 кг (200 мл), то формула для
розрахунку моляльної концентрації буде
мати вигляд:
|
|
(1.6) |
де n
– кількість молів розчиненої речовини
(![]() ).
).
Порівнюють експериментальне значення теплоти розчинення з даними довідника, визначають відносну похибку експерименту.
ЛІТЕРАТУРА: 1, с. 24 -26; 3, с. 25 29; 4, с. 8 – 12; 5, с. 46.
