
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы.
1) теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому
2) невозможен процесс, единственным результатом которого является превращение теплоты в работу
Энтропия как критерий направления процессов. В изолированной системе протекают только процессы, в которых энтропия увеличивается. Энтропия есть мера упорядоченности системы.
Цикл Карно: состоит из четырех участков и изображается PV-диаграммами. Процессы 1-2, 3-4 явл-ся изотерм., процессы 2-3, 4-1 явл-ся адиабатическими.
1-2: Пусть газ нах-ся в точке 1 с темп Т1, давл Р1 и объемом V1. Про изотерм. Расширении газ преходит в состояние 2 с давл Р2, V2, но Т1. Темп не меняется, значит не меняется внутр. Энергия. Чтобы газ изотерм. Расширялся, он должен получить от нагр Q1. При изотрем. Расширении Q1=W1
2-3: из сост 2 газ адиабатически расширяется до сост 3. Р3, V3, Т2<T1. Падение Т связано с работой газа при адиабатическом расширении, тепло не подводится и газ совершает работу за счет своей внутр энергии, в результате газ охлаждается W2=-ΔU
3-4: из сост 3газ изотерм сжимается до сост 4, характеризуемого параметрами V4, P4, T2. Над газом совершается работа при данном изотерм проц ΔU=0
4-1: из сост 4 газ адиабатно сжимается так, что он принимает исх парметры P1, V1, T1. Над газом совершается работа, газ нагревается до T1, т.к. теплоотдачи при адиабатическом проц нет –ΔW=ΔU
Уравнения для расчета энтропии для различных систем:
Изотермический процесс (Т=const): ΔS=
 (V=const)
ΔS=
(V=const)
ΔS=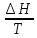 (P=const)
(P=const)Изобарный процесс (P=const): ΔS=
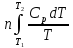 ;
ΔCp=const;
ΔS=nCpln
;
ΔCp=const;
ΔS=nCpln
Изохорный процесс (V=const): ΔS=
 ;
ΔCv=const;
ΔS=nCvln
;
ΔCv=const;
ΔS=nCvln
Для различных процессов с идеальным газом
При ΔCv=const
ΔS=nCvln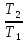 + nRln
+ nRln
Если Cp=Cv-R
ΔS=nCpln + nRln
+ nRln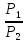
В изотермическом процессе
ΔS=nCpln =
nRln
=
nRln
В изобарном процессе
ΔS=nCpln =
nRln
=
nRln
В изохорном процессе
ΔS=nCpln =
nRln
=
nRln
Расчет изменения энтропии хим. Р-ции
 А1
+
А1
+
 А2
=
А2
=
 А3
+
А3
+
 А4
А4
Т=298
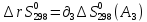 +
+
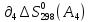 -
- -
-
T≠298


ΔCp=const


ΔCp не зависит от Т
 для неорг. Вв
для неорг. Вв
 для орг. В-в
для орг. В-в
14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, посредством которых и их производных по соответствующим независимым переменным (естественным) могут быть выражены в явном виде все термодинамические свойства си-мы. Это означает, что характеристические функции содержат в себе всю термодинамическую информацию о си-ме. Наибольшее значение имеют четыре основных термодинамических потенциала (Пав):
1) внутренняя энергия U(S,V),
2)Энтальпия H(S,p)=U+pV,
3)энергия ГельмгольцаF(T,V)=U-TS,
4)энергия ГиббсаG(T,p)=H-TS=F+pV.
В скобках указаны естественные переменные для термодинамических потенциалов. Все эти потенциалы имеют размерность энергии и все они не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле.
ϬQ=dU+ϬA, ϬA=pdV+ϬA', ϬQ=dU+pdV+δA' – первый закон термодинамики.
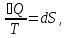 ϬQ=TdS
– второй закон термодинамики.
ϬQ=TdS
– второй закон термодинамики.
Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала: TdS=dU+ PdV=ϬA' => A'max= TdS-dU- PdV.
Рассмотрим Аmax при V=const, T=const
A’max= TdS – dU = -d(U - TS)
U - TS=F – свободная энергия Гельмгольца
A’max= -dF – изохорно-изотермический потенциал
В зависимости от условия протекания процесса различают ; термодинамических потенциала
 ПA,B
ПA,B
A'max=-ПАВ- т.е во всех случаях A'max= убыли соответствующих термодинамических потенциалов.
A'max=-ПАВ- для обратимых процессов, A'max<-ПАВ- для необратимых процессов, A'max>=-ПАВ- для любых процессов.
A'max=0, т.е си-ма находится под влиянием давления.
∆ПАВ<0 при любом самопроизвольном процессе термодинамический потенциал уменьшается и его можно использовать, как критерий направления процесса:
Если процесс идет самопроизвольно прямо, тогда ПАВ уменьшается и процесс идет в прямом направлении.
Если ПАВ уменьшается и в момент равновесия имеет минимальные значения или ПАВ равно 0, тогда процесс идет в обоих направлениях.
Если ПАВ больше 0, то процесс идет в обратную сторону, т.е не самопроизвольно.
