
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
Термодинамика (греч. термо - «тепло», динамика - «сила») - раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
Для многих систем
единственный вид работы –
работа расширения.
Практическое значение имеет обычно
работа расширения газа, причем многие
газы при достаточно низких давлениях
и сравнительно высоких температурах
приближенно подчиняются законам
идеальных газов. При расширении газа
совершается работа, которая вычисляется
по уравнению:
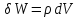 (1 )или
в интегральной форме:
(1 )или
в интегральной форме:
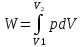 (2).
(2).
Для
интегрирования уравнения (2) нужно знать
зависимость между давлением и объемом
газа, т.е. уравнение состоTяния
газа. Эта зависимость для идеального
газа описывается уравнением состояния
Клапейрона-Менделеева:
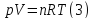 ;
гдеn-количество
идеального газа в молях; R-универсальная
газовая постоянная, равная 8,314 ДЖ/(моль∙К).
Рассмотрим
выражения для максимальной работы
расширения идеального газа в адиабатическом
процессе.
;
гдеn-количество
идеального газа в молях; R-универсальная
газовая постоянная, равная 8,314 ДЖ/(моль∙К).
Рассмотрим
выражения для максимальной работы
расширения идеального газа в адиабатическом
процессе.
Адиабатический
процесс отвечает условию Q=0.
В этом процессе одновременно изменяются
температура и давление газа. В связи с
тем, что газ не получает теплоты извне,
работа адиабатического расширения
производится за счет уменьшения
внутренней энергии и газ охлаждается:
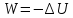 (4).
(4).
Приращение
внутренней энергии зависит от молярной
теплоемкости идеального газа при
постоянном объеме
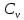 ,
т.е.:
,
т.е.: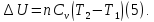
Из
сравнения уравнений (4) и (5) получаем:
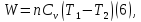 где
где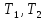 -
начальная и конечная температура,
соответственно.
-
начальная и конечная температура,
соответственно.
Из
соотношения для адиабатического
процесса, пологая
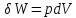 ,
получаемое выражение:
,
получаемое выражение:
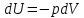 (7).
(7).
Но по
(5)
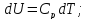 по (3) при
по (3) при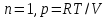 ,
поэтому имеем:
,
поэтому имеем:
Учитыва,
что для идеального газа
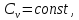 получаем
в результате интегрирования:
получаем
в результате интегрирования: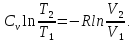 Откуда:
Откуда:
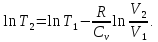
Между
параметрами p,
V,
T
при протекании адиабатического процесса
в идеальном газе имеют место соотношения:
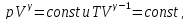 где
где
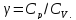
10. II закон термодинамики, формулировки. Основные понятия: самопроизвольные и не самопроизвольные процессы, обратимые и необратимые процессы. Постулат Планка. Расчет абсолютного значения энтропии.
Термодинамика (греч. термо - «тепло», динамика - «сила») - раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
Второе
начало термодинамики
– это общий закон природы, действие
которого простирается на самые разные
системы. Второе начало термодинамики
носит статистический характер и
применимо только к системам из большого
числа частиц, т.е. таким, поведение
которых подчиняется законам статистики.
Второе начало получило более полное
физическое разъяснение в статистической
термодинамике. Оно может быть выведено
из постулатов статистической
иермодинамики. Но это не противоречит
сделанному утверждению: один постулат
заменяется другим. Второе начало
термодинамики, так же как и первое
начало, является постулатом.
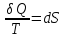 .
.
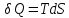 .
.
Процессы,
которые совершаются в системе без
вмешательства со стороны окружающей
среды, называются самопроизвольными.
Эти процессы протекают или в изолированной
системе, или в неизолироанной,
сопровождаясь уменьшением внутренней
энергии системы и передачей энергии в
окружную среду в форме теплоты или
работы, или, наоборот, увелечением
внутренней энергии за счет теплоты и
работы полученной из окружающей среды.
Процессы, которые без «вмешательства
извне» сами собой совершаться не могут,
называются несамопроизвольными,
неестественными или отрицательными.Такие
процессы не могут происходить в
изолированной системе, так как для
этого они требуют воздействия извне,
сос стороны окружающей среды. Необратимыми
процессами
называются такие процессы, после
протекания которых систему и окружающую
среду одновременно нельзя вернуть в
прежнее состояние. При необратимом
процессе систему можно вернуть к
первоначальному состоянию, но при этом
в окружающей среде останутся некоторые
изменения, «следы» необратимого
процесса. Обратимыми
процессами
называются такие процессы, после которых
можно вернуть и систему, и окражующую
среду в прежнее состояние. При этом в
обратном процессе система проходит
через те же промежуточные состояния,
что и в прямом процессе, но в обртном
порядке.
![]()
Постулат Планка:
энтропия индивидуального кристаллического
вещества при абсолютном нуле равна
нулю: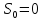 .
Постулат Планка
справедлив только для индивидуальных
веществ, кристаллы которых идеально
построены (в кристаллической решетке
все узлы заняты молекулами или атомами,
правильно чередующимися и закономерно
ориентированными). Такие кристаллы
называются идеальными твердыми телами.
Реальные кристаллы не являются таковыми,
так как их кристаллическая решетка
построена не идеально.
В соответствии с постулатом Планка
уравнение для идеального твёрдого тела
примет вид:
.
Постулат Планка
справедлив только для индивидуальных
веществ, кристаллы которых идеально
построены (в кристаллической решетке
все узлы заняты молекулами или атомами,
правильно чередующимися и закономерно
ориентированными). Такие кристаллы
называются идеальными твердыми телами.
Реальные кристаллы не являются таковыми,
так как их кристаллическая решетка
построена не идеально.
В соответствии с постулатом Планка
уравнение для идеального твёрдого тела
примет вид:
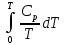 .
.
