
- •1. Физическая химия: цель, задачи, методы исследования. Основные понятия физической химии.
- •3 .Следствия первого начала термодинамики ( изохорный и изобарный процессы). Способы записи теплот химических реакций.
- •4. Закон Гесса, его следствия. Взаимосвязь между тепловым эффектом химической реакции при постоянном объеме и давлении.
- •7. Зависимость тепловых эффектов химических реакций от температуры. Уравнение Киргоффа. Определение реакции при нестандартной температуре.
- •9. Работа расширения для идеальных газов при адиабатическом процессе. Вывести уравнения адиабат.
- •11. II закон термодинамики для обратимых и необратимых процессов. Свойства энтропии.
- •12.Расчет изменения энтропии для различных физико-химических процессов: нагревание, фазовые переходы, смешение идеальных газов, изобарный, изотермический, изохорныйпроцессы.
- •13. Расчет изменения энтропии реакции при стандартной и нестандартной температурах (на примере реакций с участием неорганических веществ)
- •14.Изохорно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса.
- •15. Изобарно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •16) Изобарно-изотермический потенциал, его свойства, применение в качестве критерия направленности процесса
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •17. Изохорно-изоэнтропийный потенциал, его свойства, применение в качестве критерия направленности процесса.
- •18) Уравнение Гиббса – Гельмгольца. Определение изменения энергии Гиббса реакции при не стандартной температуре.
- •19) Химический потенциал, определение, условие равновесия в открытых системах. Химический потенциал идеальных и реальных систем (газы, растворы).
- •20) Химическое равновесие, вывод уравнения изотермы химической реакции. Определение стандартного значения константы равновесия реакций.
- •23) Влияние температуры на константу равновесия, вывод уравнения изобары Вант- Гоффа. Принцип Ле- Шателье.
- •25) Расчёт теп.Эф х.Р. На основе изобары Вант-Гоффа (расчётный и граф. Способы).
- •26) Расчёт теп.Эф х.Р. На основе изохоры Вант-Гоффа (расчётный и граф. Способы).
- •27)Фазовые равновесия основные опр-я:
- •28)Равновесие чис-го в-ва в 2-х фазах одноком.Сис-мы.
- •29) Определение теплоты спарение расчетным и графическим способами на основе уравнения Клаузиуса – Клапейрона.
- •30) Гетерогенное равновесие. Бинарные системы. Законы Рауля. Законы Коновалова.
- •31) Основные понятия химической кинетики: скорость, механизм реакции.
- •32) Основной постулат химической кинетики. Гомогенные, гетерогенные реакции. Порядок и молекулярность реакции, отличая между ними.
- •33) Влияние концентрации на скорость химической реакции. Физический смысл, размерность константы скорости.
- •34) Кинетический анализ необратимых реакций первого порядка в закрытых системах.
- •35) Кинетический анализ необратимых реакций второго порядка в закрытых системах.
- •36) Кинетический анализ необратимых реакций нулевого порядка в закрытых системах.
- •37)Реакции 3-ого порядка
- •41. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, закон Аррениуса.
- •42. Энергия активации, ее физический смысл. Методы определения энергии активации.
- •43.Катализ, основные свойства катализатора
- •44. Биогенные каталитические реакции. Кинетический анализ гомогенной каталитической реакции.
- •45. Электрохимия, особенности электрохимических реакций.
- •48. Приближения теории Дебая – Гюккеля, их концентрационные пределы применимости.
- •49) Основы теории электролитической диссоциации
- •50) Основные достоинства и недостатки тэд Аррениуса. Энергия кристаллической решетки, энергия сольватации.
- •51) Свойства буферных растворов, определение их рН, буферная емкость, диаграмма.
- •52) Определение рН гидратообразования и произведения растворимости гирооксидов металлов.
- •53. Удельная электропроводность растворов электролитов, зависимость от температуры и концентрации.
- •54. Молярная электропроводность. Закон Кольрауша. Определение молярной электропроводности при бесконечном разбавлении растворов сильных и электролитов.
- •55. Молярная электропроводность. Влияние температуры и концентрации на молярную электропроводность растворов сильных и слабых электролитов.
- •56. Электролиз, законы электролиза. Электролиз водных растворов солей с инертным анодом (привести пример).
- •57. Определение стандартного значения электродных потенциалов. Уравнение Нернста для определения эдс цепей.
- •58. Классификация электродов, правила записи электродов и цепей.
- •59.Химические цепи(гальванический элемент), их классификация.
- •60.Гальванический элемент. Термодинамика гальванического элемента.
42. Энергия активации, ее физический смысл. Методы определения энергии активации.
Энергия активации - минимальное количество энергии, которое требуется сообщить системе (джоуль на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea
В химической модели, известной как Теория активных соударений, есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
Молекулы должны быть правильно ориентированы относительно друг друга.
При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
Уравнение
Аррениуса устанавливает
связь между энергией активации и
скоростью протекания реакции:![]()
k — константа скорости реакции, A — фактор частоты для реакции, R — универсальная газовая постоянная, T — температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
![]()
где γ — температурный коэффициент скорости (его значение лежит в интервале от 2 до 4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
Переходное
состояние —
состояние системы, при котором
уравновешены разрушение и создание
связи. В переходном состоянии система
находится в течение небольшого (10−15 с)
времени. Энергия, которую необходимо
затратить, чтобы привести систему в
переходное состояние, называется
энергией активации. В многоступенчатых
реакциях, которые включают в себя
несколько переходных состояний, энергия
активации соответствует наибольшему
значению энергии. После преодоления
переходного состояния молекулы вновь
разлетаются с разрушением старых связей
и образованием новых или с преобразованием
исходных связей. Оба варианта возможны,
так как происходят с высвобождением
энергии. Существуют вещества, способные
уменьшить энергию активации для данной
реакции. Такие вещества называют катализаторами.
Биологи же такие вещества
называют ферментами.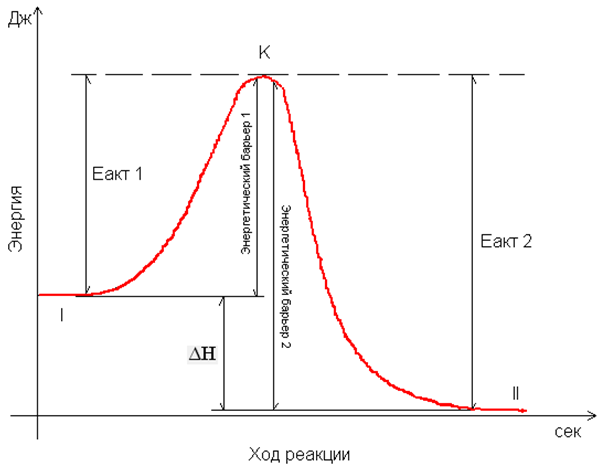 I
- энергетический уровень до реакции
I
- энергетический уровень до реакции
II - более низкий энергетический уровень после реакции
ΔН - выделившиеся энергия в ходе реакции
К – уровень наименьшего запаса энергии, для взаимодействия молекул
Еакт 1 - энергия активации прямой реакции
Еакт 2 - энергия активации обратной реакции
В большинстве случаев для расчета энергии активации Еа по экспериментальным данным используют интегральную форму уравнения Вант-Гоффа-Аррениуса или его запись в виде:
lgK = lgKo - Е а/2,303 RT (9)
Следовательно, lgK линейно зависит от обратной абсолютной температуры
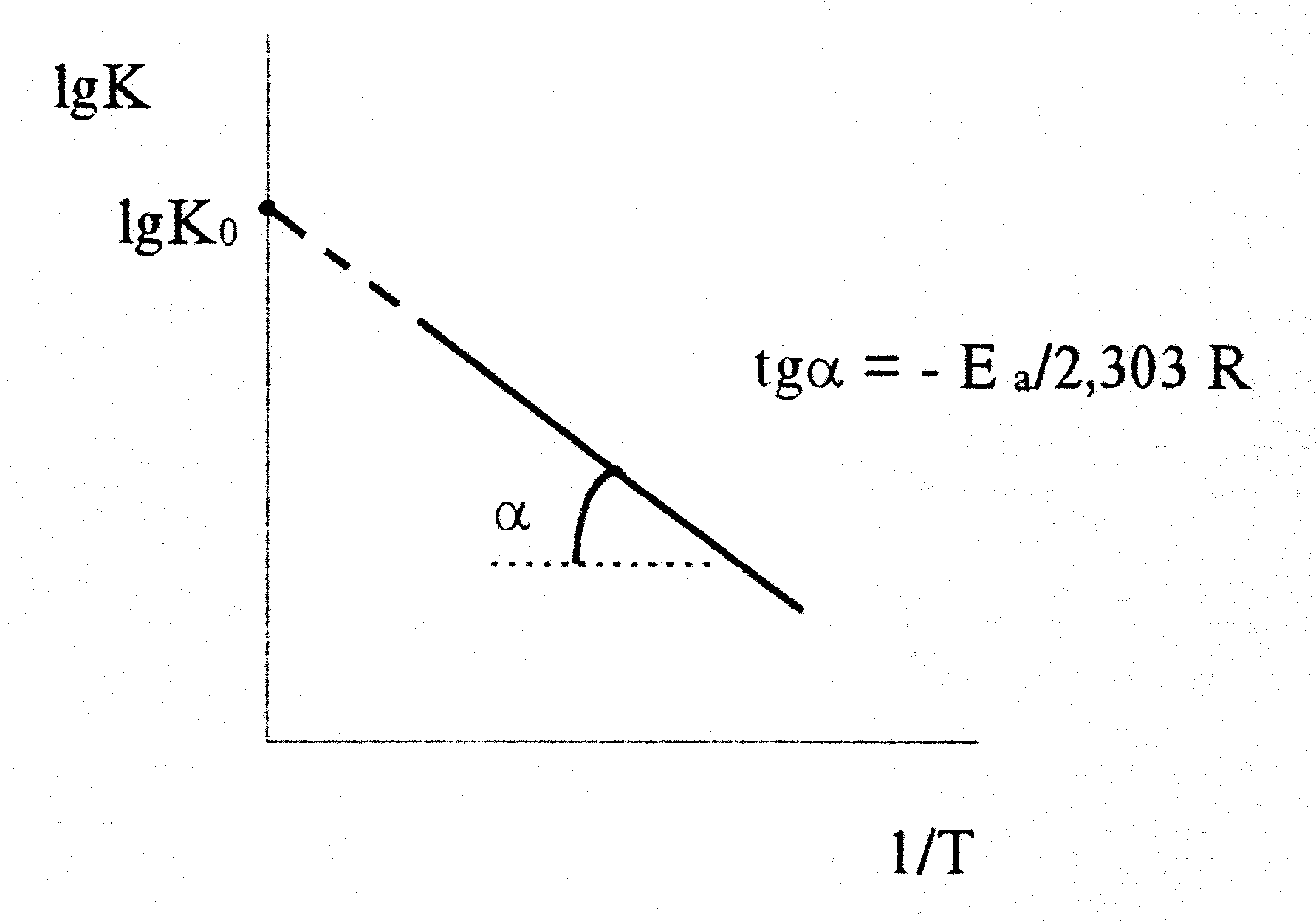 Значение
Еа
находят по тангенсу угла наклона прямой,
проходящей через экспериментальные
точки: Е а=
-2,303Rtgα.
Значение
Еа
находят по тангенсу угла наклона прямой,
проходящей через экспериментальные
точки: Е а=
-2,303Rtgα.
Предэкспоненциальный множитель К0 определяется отрезком, отсекаемым продолжением прямой на оси ординат при 1/Т = 0.
Если имеются значения константы скорости химической реакции при двух температурах, то из уравнения (9) можно получить:
Еа =(2,303RT1T2 lgK2 /K1 )/(T2-T1) (10)
Энергия активации Еа имеет размерность энергия/моль и измеряется в единицах Дж/моль. Размерность К0 совпадает с размерностью константы скорости. Теория и экспериментальные данные (для широкого температурного интервала) показывают, что Еа и К зависят от температуры. Однако эту зависимость можно не учитывать, если реакции исследуются в достаточно узком температурном интервале.
Изложенный выше метод расчета Еа предполагает, что константы скорости реакций при различных температурах известны.
Однако, есть способ расчета Еа, так называемый метод трансформации, который не требует знания K=f(T).
Пусть при температурах T1 и T2 в смесях одного и того же начального состава протекает химическая реакция. Если к моментам времени τ1 и τ2 реакция прошла на одну и ту же глубину, то есть изменения концентраций исходных веществ или продуктов реакции одинаковы, то отношение скоростей реакции равно:
W1 / W2 = (dC/d τ1 ) /(dC/d τ2) = d τ2 / d τ1. (11)
Заменим в уравнении (11) скорости реакций при заданных температурах соотношением
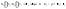 .
(11а)
.
(11а)
Таким образом, отношение K1 /K2 можно заменить отношением τ1 / τ2
Подставим в отношение (11а) значения констант скорости при температурах T1 и Т2, используя уравнение Аррениуса:
K0exp(-Ea/RT1)/ K0exp(-Ea/RT2) = d τ2 / d τ1.
Полагая, что для узкого температурного интервала К0 и Еа= const находим
ехр[-Ea/R(l/T1 - 1/Т2)] = d τ2 / d τ1. (12)
Разделение переменных и интегрирование дают:
ехр[-Еа(Т2 – T1 )/RT1 T2 ] = τ2 / τ1. (13)
Следовательно, при заданных T1 и Т2 отношение τ2 / τ1 для реакций, протекающих на одну и ту же глубину, постоянно и называется коэффициентом трансформации. Если этот коэффициент известен, то значение энергии активации рассчитывается по формуле:
Еа = R[T1 T2 /(Т2 – T1)]-ln(τ2 / τ1).
